Las enzimas que dividen las proteínas desempeñan un papel importante en muchos procesos fisiológicos. Estas proteasas generalmente están presentes en un estado inactivo y sólo se activan bajo ciertas condiciones. Algunos están relacionados con enfermedades como infecciones o cáncer, por lo que es importante contar con métodos que puedan detectar selectivamente las proteasas activas.
En un artículo publicado en la revista Angewandte Chemie International Edition , los científicos han introducido una nueva clase de sensores de actividad de proteasa:nanopartículas de oro equipadas con ADN peptídico.
Dirigido por Devleena Samanta y Anna Capasso (Universidad de Texas en Austin, EE. UU.), el equipo ha demostrado que estas nanosondas pueden detectar múltiples proteasas activas en paralelo (medición multiplexada). El método funciona a temperatura ambiente y no requiere una preparación de muestras complicada ni instrumentos elaborados.
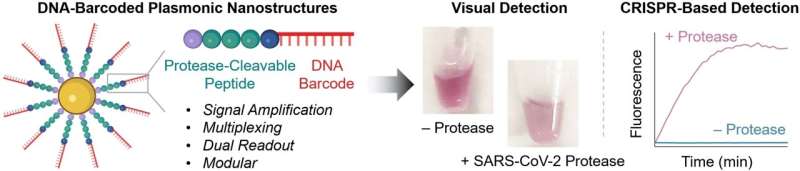
En el núcleo de las nuevas sondas se encuentran nanopartículas de oro equipadas con cadenas formadas por un péptido y un fragmento de ADN. La estructura peptídica está diseñada para ser dividida por la proteasa que se detecta. El ADN actúa como un código de barras único para identificar el péptido y también amplifica la señal. Si la proteasa deseada está presente en su forma activa en la muestra, el péptido la descompone. Esto libera el código de barras de ADN en la solución, donde se puede detectar en función de su secuencia.
Para realizar esta detección, el equipo utiliza una prueba CRISPR/Cas12a:la enzima Cas12a se une a un ARN guía (ARNg) para formar un complejo inactivo. El ARNg contiene un segmento que se une específicamente al ADN del código de barras. Esto activa Cas12a, de modo que ahora puede "cortar" el ADN monocatenario (ssDNA).
Para la prueba, los investigadores añaden moléculas de ADN ss con un grupo fluorescente (fluoróforo) en un extremo y un extintor, que "apaga" la fluorescencia del fluoróforo (siempre que estén lo suficientemente cerca), en el otro. Si se corta el ssDNA, el fluoróforo y el extintor se separan aún más. Esto da como resultado una fuerte fluorescencia que indica que la proteasa que se está analizando está presente (límite de detección de aproximadamente 58 pM).
Si no hay instrumentos disponibles en el lugar y la prueba debe realizarse rápidamente, la detección es posible a simple vista:si la proteasa divide el péptido en la sonda, la carga superficial de las nanopartículas de oro cambia y se agregan. El color de las llamadas "nanoestructuras plasmónicas" depende en gran medida de su grado de agregación. Es posible detectar concentraciones de proteasa nanomolar basándose en el cambio de color en la solución de prueba.
La detección multiplexada de las proteasas 3CL y caspasa3 permitió al equipo demostrar la alta sensibilidad y selectividad de su nuevo método. 3CL es un marcador de infección activa por coronavirus y los pacientes con COVID a menudo también tienen una actividad elevada del marcador de apoptosis caspasa3. El potencial clínico de esta prueba también quedó demostrado por la detección de catepsina B, una proteasa relacionada con el cáncer colorrectal, en tres líneas celulares tumorales diferentes obtenidas de pacientes.
Estas nanosondas producen señales de fluorescencia 100 veces mayores en comparación con los sensores de proteasa comerciales basados en fluorescencia. Además, prácticamente cualquier proteasa puede detectarse si se conoce el péptido que divide. En conjunto, estas nanosondas pueden permitir la detección temprana de enfermedades y mejorar la precisión y confiabilidad de las pruebas de diagnóstico mediante la multiplexación.
Más información: Subrata Pandit et al, Nanoestructuras plasmónicas con código de barras de ADN para la detección de proteasa basada en actividad, Edición internacional Angewandte Chemie (2023). DOI:10.1002/anie.202310964
Información de la revista: Edición internacional Angewandte Chemie
Proporcionado por Wiley