¿Es posible cultivar tejido en el laboratorio, por ejemplo para reemplazar el cartílago lesionado? En TU Wien (Viena), se ha dado un paso importante hacia la creación de tejido de reemplazo en el laboratorio, utilizando una técnica que difiere significativamente de otros métodos utilizados en todo el mundo. El estudio se publica en Acta Biomaterialia .
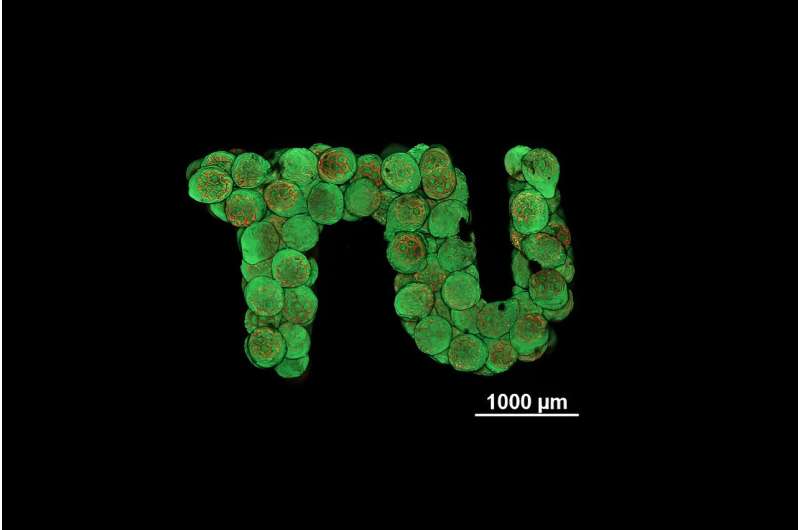
Se utiliza un proceso especial de impresión 3D de alta resolución para crear pequeñas esferas porosas hechas de plástico biocompatible y degradable, que luego son colonizadas con células. Luego, estos esferoides pueden disponerse en cualquier geometría y las células de las diferentes unidades se combinan perfectamente para formar un tejido vivo uniforme. El tejido cartilaginoso, con el que ahora se ha demostrado el concepto en la Universidad Técnica de Viena, se consideraba hasta ahora especialmente complicado a este respecto.
"Cultivar células de cartílago a partir de células madre no es el mayor desafío. El principal problema es que normalmente se tiene poco control sobre la forma del tejido resultante", dice Oliver Kopinski-Grünwald del Instituto de Ciencia y Tecnología de Materiales de la TU Wien, uno de los autores del presente estudio. "Esto también se debe al hecho de que estos grupos de células madre cambian de forma con el tiempo y a menudo se encogen."
Para evitarlo, el equipo de investigación de la Universidad Técnica de Viena está trabajando con un nuevo enfoque:mediante sistemas de impresión 3D de alta resolución basados en láser especialmente desarrollados se crean pequeñas estructuras en forma de jaulas que parecen mini balones de fútbol y tienen un diámetro de solo un tercio. de un milímetro. Sirven como estructura de soporte y forman bloques de construcción compactos que luego se pueden ensamblar en cualquier forma.
Las células madre se introducen primero en estas minijaulas con forma de balón de fútbol, que rápidamente llenan por completo el pequeño volumen. "De esta manera podemos producir de forma fiable elementos de tejido en los que las células están distribuidas uniformemente y la densidad celular es muy alta. Esto no hubiera sido posible con enfoques anteriores", explica el profesor Aleksandr Ovsianikov, jefe del Departamento de Impresión y Biofabricación 3D. grupo de investigación de TU Wien.

Creciendo juntos perfectamente
El equipo utilizó células madre diferenciadas, es decir, células madre que ya no pueden convertirse en ningún tipo de tejido, pero que ya están predeterminadas para formar un tipo específico de tejido, en este caso tejido cartilaginoso. Estas células son particularmente interesantes para aplicaciones médicas, pero la construcción de tejido más grande es un desafío cuando se trata de células de cartílago. En el tejido cartilaginoso, las células forman una matriz extracelular muy pronunciada, una estructura similar a una malla entre las células que a menudo impide que diferentes esferoides celulares crezcan juntos de la forma deseada.
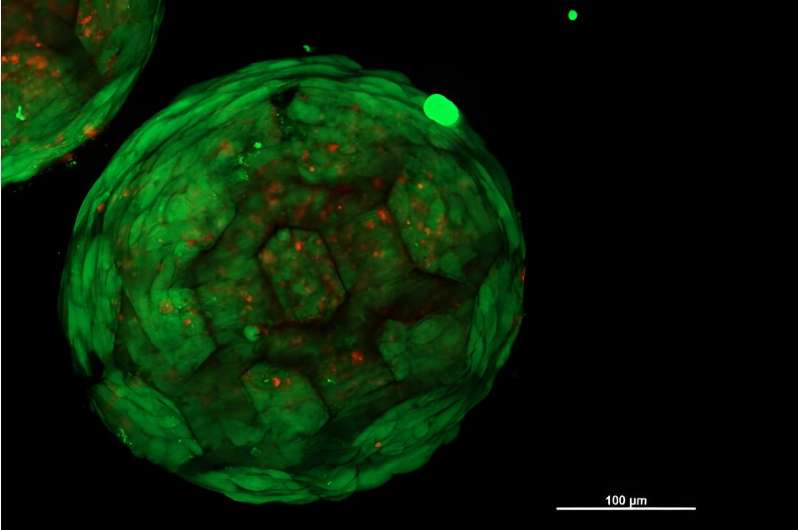
Si los esferoides porosos impresos en 3D se colonizan con células de la forma deseada, los esferoides se pueden disponer en cualquier forma deseada. La pregunta crucial ahora es:¿las células de diferentes esferoides también se combinan para formar un tejido uniforme y homogéneo?
"Esto es exactamente lo que hemos podido demostrar por primera vez", afirma Kopinski-Grünwald. "Bajo el microscopio se puede ver muy claramente:los esferoides vecinos crecen juntos, las células migran de un esferoide a otro y viceversa, se conectan perfectamente y dan como resultado una estructura cerrada sin cavidades, a diferencia de otros métodos que se han utilizado hasta ahora. utilizado hasta ahora, en el que quedan interfaces visibles entre grupos de células vecinas."
Los diminutos andamios impresos en 3D dan estabilidad mecánica a la estructura general mientras el tejido continúa madurando. Al cabo de unos meses, las estructuras plásticas se degradan, simplemente desaparecen, dejando el tejido acabado con la forma deseada.
Primer paso hacia la aplicación médica
En principio, el nuevo enfoque no se limita al tejido cartilaginoso, sino que también podría utilizarse para adaptar diferentes tipos de tejidos más grandes, como el tejido óseo. Sin embargo, todavía quedan algunas tareas por resolver:después de todo, a diferencia del tejido cartilaginoso, a partir de un cierto tamaño también habría que incorporar vasos sanguíneos a estos tejidos.
"Un primer objetivo sería producir pequeños trozos de tejido cartilaginoso hechos a medida que puedan insertarse en el material cartilaginoso existente después de una lesión", afirma Oliver Kopinski-Grünwald. "En cualquier caso, ahora hemos podido demostrar que nuestro método para producir tejido cartilaginoso mediante microestructuras esféricas funciona en principio y tiene ventajas decisivas sobre otras tecnologías".
Más información: Oliver Kopinski-Grünwald et al, Los esferoides andamiados como bloques de construcción para la ingeniería de tejido cartilaginoso de abajo hacia arriba muestran una dinámica de bioensamblaje mejorada, Acta Biomaterialia (2023). DOI:10.1016/j.actbio.2023.12.001
Proporcionado por la Universidad Tecnológica de Viena