Los fármacos a base de proteínas deben transportarse al interior de las células de forma que se impida su degradación inmediata. Un nuevo enfoque pretende garantizar que permanezcan intactos sólo en determinadas células, como las células cancerosas. En un estudio publicado en la revista Angewandte Chemie International Edition , un equipo de investigación japonés ha introducido un nanoportador que puede "escapar" de los endosomas antes de que su carga se destruya allí. Esta capacidad de escapar sólo se activa dentro de los endosomas de determinadas células tumorales.
La absorción de nanoportadores en las células se produce por endocitosis:cuando un nanoportador aterriza en la superficie celular, la membrana celular se pliega y lo encierra en una burbuja, llamada endosoma, que luego se desplaza hacia el interior de la célula. En su fase tardía, el endosoma se fusiona con lisosomas que contienen enzimas, formando un endolisosoma. Dentro de esta estructura, las enzimas descomponen tanto el material del cuerpo como el material extraño.
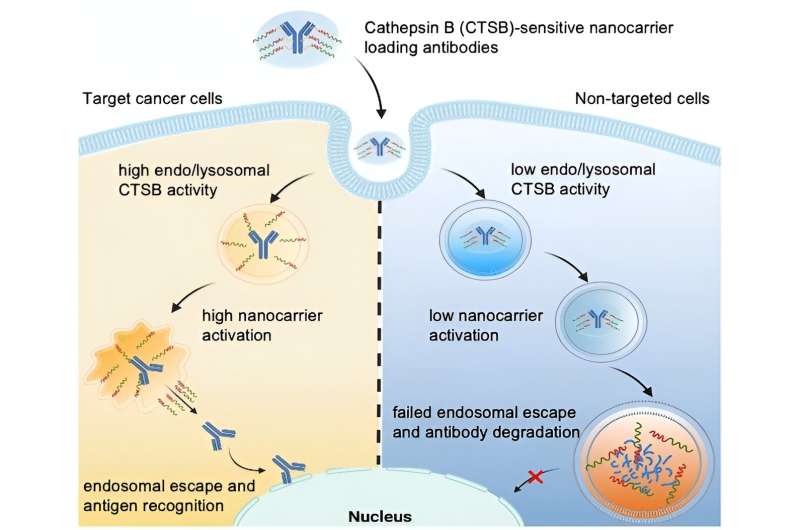
Un fármaco a base de proteínas sólo puede volverse activo si "escapa" del endolisosoma antes de descomponerse. Esto se conoce como "escape endosómico". Algunos nanoportadores pueden abrir la membrana endo/lisosomal y, por tanto, tener capacidad de escape endosomal.
Dirigido por Kazunori Kataoka y Horacio Cabral, el equipo pretende ir un paso más allá produciendo nanoportadores cuyo escape endosomal sólo se activa cuando entran en células muy específicas, como las células tumorales. Esto protegería las células sanas. Los investigadores aprovechan el hecho de que diferentes tipos de células tienen actividades enzimáticas endolisosomales muy diferentes. Por ejemplo, la actividad de la proteasa catepsina B (CTSB) es especialmente alta en las células cancerosas.
Con el uso de moléculas sonda de fluorescencia especiales, el equipo de la Universidad de Tokio y el Instituto Kawasaki de Promoción Industrial estudiaron inicialmente la actividad CTSB y la degradación de proteínas en los endosomas. Determinaron que en las células cancerosas con endosomas altamente ácidos, la actividad CTSB ya es muy alta en su fase inicial, significativamente antes de que aumente la degradación de las proteínas. Los investigadores aprovechan esta ventana de tiempo utilizando nanoportadores cuya capacidad de escape endosómico es activada por el CTSB en las células cancerosas.
El equipo construyó nanoportadores a base de poli(etilenglicol) con grupos diaminoetano capaces de "desgarrar" membranas endo/lisosomales. Utilizando un conector, luego unieron anticuerpos para que actuaran como modelo para un fármaco proteico. El nanoportador protege las "herramientas de desgarro" para que inicialmente estén inactivas.
El conector está diseñado para ser dividido por el CTSB en los endolisosomas. Esto separa la carga del transportador, activando las herramientas de desgarro. Abren la membrana endo/lisosomal y liberan anticuerpos intactos en el interior de la célula, pero solo en células tumorales que tienen una actividad CTSB endosómica elevada.
Este método podría representar una nueva estrategia para la liberación celular específica de fármacos a través de nanoportadores que responden a estímulos con escape endosómico controlado.
Más información: Pengwen Chen et al, Administración intracelular selectiva de anticuerpos en células cancerosas con nanoportadores que detectan la actividad enzimática endo/lisosomal, Angewandte Chemie International Edition (2024). DOI:10.1002/anie.202317817
Información de la revista: Edición internacional Angewandte Chemie
Proporcionado por Wiley