Los receptores de antígenos quiméricos (CAR) son proteínas de membrana sintetizadas que permiten a los linfocitos reconocer y responder a los antígenos específicos de las células diana. A pesar de la impresionante eficacia de la terapia con células CAR-T en el tratamiento del linfoma o la leucemia de células B, el costoso y complejo proceso de fabricación ha dificultado su aplicación clínica generalizada.
Investigaciones anteriores han explorado el uso de nanopartículas para administrar ácidos nucleicos para programar células T circulantes in vivo, agilizando la generación de células CAR-T y obviando la necesidad de aislar células T de pacientes. Mientras tanto, insertar la proteína CAR directamente en la membrana de las células T podría presentar un método sencillo, evitando complicaciones como el síndrome de liberación de citoquinas (SLC) y el riesgo tumorigénico asociado con la inserción aleatoria de genes virales en el genoma.
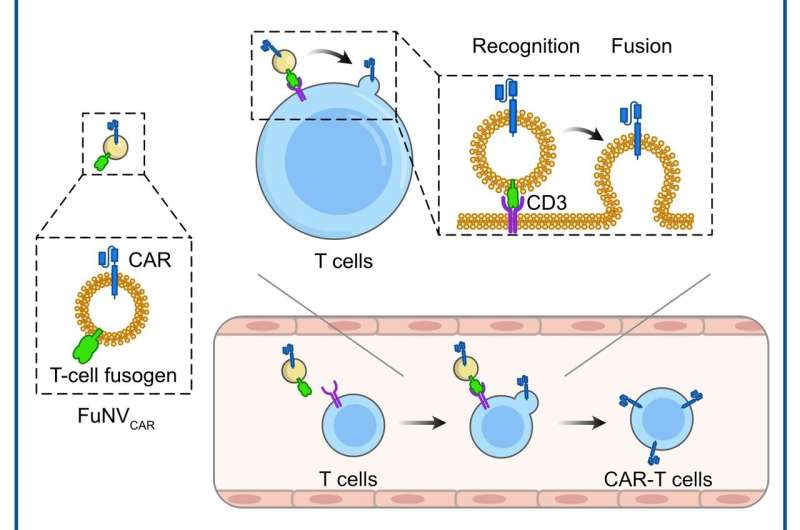
Dirigidos por el Prof. Jun Wang y el Prof. Cong-Fei Xu de la Facultad de Ciencias Biomédicas e Ingeniería de la Universidad Tecnológica del Sur de China, los investigadores han desarrollado una estrategia prometedora que implica la fusión directa de moléculas CAR, preexpresadas en nanovesículas fusogénicas. (FuNV), a las células T, construyendo así células CAR-T in vivo.
Diseñaron el fusogen de células T añadiendo un fragmento variable de cadena sencilla anti-CD3 al reovirus o al fusogen del virus del sarampión. Demostraron que los FuNV derivados de células que expresan fusógeno de células T portaban una cantidad sustancial de fusógeno de células T, lo que inducía eficientemente la fusión entre NV y células T tanto in vitro como in vivo.
Posteriormente, considerando el éxito clínico de las células CAR-T anti-CD19 (αCD19), las células diseñadas que expresan fusogen de células T y la proteína CAR αCD19 se construyeron para producir FuNV portadores de CAR αCD19 (FuNVCAR ). La producción de células CAR-T se logró con éxito mediante la administración de proteína CAR a las células T a través de FuNVCAR in vitro e in vivo. Mientras tanto, la inyección intravenosa de FuNVCAR inhibió eficazmente el crecimiento del linfoma de células B.
Para explorar más a fondo la toxicidad potencial de FuNVCAR , se realizaron recuentos sanguíneos y análisis bioquímicos séricos a los 2 y 14 días, lo que demuestra comparabilidad con el grupo de control. Durante todo el tratamiento con FuNVCAR , no se observaron alteraciones significativas en el peso corporal en ratones.
Además, a diferencia del tratamiento tradicional con células CAR-T, el tratamiento con FuNVCAR no indujo una liberación elevada de citoquinas inflamatorias. Esta diferencia observada se puede atribuir a las células CAR-T transitorias producidas por FuNVCAR , que sufre una activación limitada y temporal, mitigando la liberación sostenida de citocinas inflamatorias.
En resumen, este estudio presenta un enfoque novedoso para la producción de células CAR-T in vivo mediante la administración de proteínas CAR mediada por FuNV. Es esencial tener en cuenta, sin embargo, que esta estrategia puede no ser adecuada para pacientes con función de células T comprometida.
Los hallazgos se publican en la revista Science Bulletin. .
Más información: Gui Zhao et al, Producción in vivo de células CAR-T utilizando nanovesículas fusogénicas miméticas de virus, Science Bulletin (2023). DOI:10.1016/j.scib.2023.11.055
Proporcionado por Science China Press