Las vacunas terapéuticas contra el cáncer son una forma de inmunoterapia en ciernes que no sólo podría destruir las células cancerosas en los pacientes, sino también evitar que el cáncer regrese y se propague. Se están estudiando múltiples vacunas terapéuticas contra el cáncer en ensayos clínicos, pero a pesar de lo prometedoras, los oncólogos clínicos aún no las utilizan de forma rutinaria para tratar a sus pacientes.
El ingrediente central de las vacunas terapéuticas contra el cáncer son los antígenos, que son producidos preferentemente o recién producidos (neoantígenos) por las células tumorales y permiten que el sistema inmunológico del paciente busque y destruya las células cancerosas.
En la mayoría de los casos, esos antígenos no pueden actuar solos y necesitan la ayuda de moléculas adyuvantes que desencadenan una señal de alarma general en las células inmunitarias conocidas como células presentadoras de antígenos (APC). Las APC internalizan tanto el antígeno como las moléculas adyuvantes y presentan los antígenos a diferentes tipos de células T. Luego, esas células T lanzan un ataque inmediato contra el tumor o preservan una memoria más duradera del tumor para futuras defensas.
La eficacia de una vacuna contra el cáncer depende del nivel y la duración de la "alarma" que sus adyuvantes pueden hacer sonar en las APC. Anteriormente, los investigadores descubrieron que la administración simultánea de moléculas de adyuvante y antígeno a las APC utilizando nanoestructuras como el origami de ADN puede aumentar la activación de las APC. Sin embargo, ninguno de estos enfoques investigó sistemáticamente cómo el número y la disposición a nanoescala de las moléculas adyuvantes afectan la inmunidad dirigida al tumor.
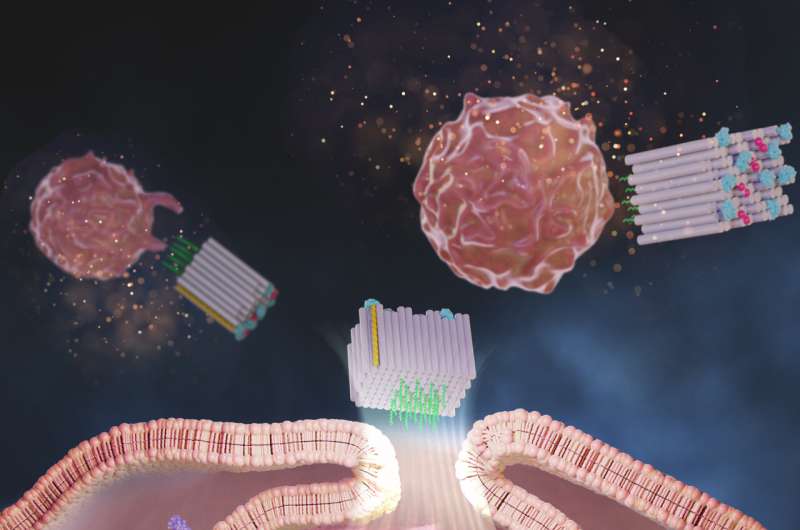
Ahora, un equipo de investigación del Instituto Wyss de la Universidad de Harvard, el Instituto del Cáncer Dana-Farber (DFCI), la Facultad de Medicina de Harvard (HMS) y el Instituto Coreano de Ciencia y Tecnología (KIST) ha creado una plataforma de origami de ADN llamada DoriVac, cuyo núcleo El componente es una nanoestructura autoensamblable en forma de bloque cuadrado.
A una cara del bloque cuadrado, se pueden unir números definidos de moléculas adyuvantes en patrones nanoprecisos altamente sintonizables, mientras que la cara opuesta puede unirse a antígenos tumorales. El estudio encontró que las moléculas de un adyuvante conocido como CpG espaciadas exactamente 3,5 nanómetros entre sí dieron como resultado la estimulación más beneficiosa de las APC que indujeron un perfil altamente deseable de células T, incluidas aquellas que matan las células cancerosas (células T citotóxicas). aquellos que causan inflamación beneficiosa (células T polarizadas Th-1) y aquellos que proporcionan una memoria inmune a largo plazo del tumor (células T de memoria).
Las vacunas DoriVac permitieron a los ratones portadores de tumores controlar mejor el crecimiento de los tumores y sobrevivir mucho más tiempo que los ratones de control. Es importante destacar que los efectos de DoriVac también tuvieron sinergia con los de los inhibidores de puntos de control inmunológico, que son una inmunoterapia de gran éxito que ya se utiliza ampliamente en la clínica. Los hallazgos se publican en Nature Nanotechnology. .
"La tecnología de vacuna de origami de ADN de DoriVac fusiona diferentes capacidades nanotecnológicas que hemos desarrollado a lo largo de los años con un conocimiento cada vez más profundo sobre los procesos inmunológicos que suprimen el cáncer", dijo William Shih, Ph.D., Ph.D., miembro de la facultad principal de Wyss y quien dirigió el equipo del Instituto Wyss. junto con el primer autor Yang (Claire) Zeng, M.D., Ph.D.
"Prevemos que en el futuro, los antígenos identificados en pacientes con diferentes tipos de tumores podrían cargarse rápidamente en origami de ADN prefabricados que contienen adyuvantes para permitir vacunas contra el cáncer personalizadas y altamente efectivas que puedan combinarse con inhibidores de puntos de control aprobados por la FDA en terapias combinadas. "
Shih también es profesor en HMS y en el Departamento de Biología del Cáncer del DFCI y, como algunos de los otros autores, miembro del Centro interinstitucional "Inmunoingeniería para mejorar la inmunoterapia" (i3) con sede en Wyss.
El adyuvante CpG es una hebra sintética de ADN formada por motivos repetidos de nucleótidos CpG que imitan el material genético de patógenos bacterianos y virales que invaden las células inmunitarias. Al igual que sus homólogos naturales, los adyuvantes CpG se unen a un "receptor de peligro" llamado TLR9 en las células inmunitarias, que a su vez induce una respuesta inmunitaria inflamatoria (innata) que funciona en conjunto con la respuesta inmunitaria (adaptativa) inducida por antígeno.
"Sabíamos por trabajos anteriores que para desencadenar fuertes respuestas inflamatorias, los receptores TLR9 necesitan dimerizarse y agregarse en complejos multiméricos que se unen a múltiples moléculas CpG. Las distancias a nanoescala entre los dominios de unión a CpG en ensamblajes TLR9 efectivos reveladas por el análisis estructural cayeron directamente en el gama de lo que hipotetizamos que podríamos reflejar con estructuras de origami de ADN que presentan moléculas CpG espaciadas con precisión", explicó Zeng, quien era instructor de medicina en el momento del estudio y ahora es científico senior en DFCI y la Escuela de Medicina de Harvard (HMS).
Además de Shih, Zeng también fue asesorado en el proyecto por los autores principales Ju Hee Ryu, Ph.D., investigador principal de KIST, y el miembro fundador de Wyss Core Faculty, David Mooney, Ph.D., quien también es profesor en Harvard. Escuela de Ingeniería y Ciencias Aplicadas John A. Paulson (SEAS) y uno de los investigadores principales del Centro i3.
Zeng y el equipo fabricaron vacunas DoriVac en las que se espaciaban diferentes números de hebras CpG a 2,5, 3,5, 5 o 7 nanómetros entre sí en una cara del bloque cuadrado, y se adjuntó un antígeno modelo a la cara opuesta. Protegieron sus estructuras para que no se degradaran en el cuerpo utilizando un método de modificación química que el grupo de Shih había desarrollado anteriormente.
Cuando fueron internalizadas por diferentes tipos de APC, incluidas las células dendríticas (DC), que orquestan las respuestas de las células T dirigidas a los tumores, las vacunas DoriVac mejoraron la absorción de antígenos en comparación con los controles que consisten en moléculas de antígenos libres.
Un espaciamiento de CpG de 3,5 nanómetros produjo las respuestas más fuertes y beneficiosas en las APC, y superó significativamente a una vacuna de control que contenía solo moléculas de CpG libres.
"Nos entusiasmó descubrir que la vacuna DoriVac inducía preferentemente un estado de activación inmunitaria que apoya la inmunidad antitumoral, que es lo que los investigadores generalmente quieren ver en una buena vacuna", afirmó Zeng.
Además del espaciamiento, también importó el número de moléculas CpG en las vacunas DoriVac. El equipo probó vacunas que contenían entre 12 y 63 moléculas CpG espaciadas de manera óptima y descubrió que 18 moléculas CpG proporcionaban la mejor activación de APC. Esto significó que su enfoque también puede ayudar a limitar la dosis de moléculas CpG y así minimizar los efectos secundarios tóxicos comúnmente observados con los adyuvantes.
Es importante destacar que estas tendencias in vitro se tradujeron en modelos de tumores de ratón in vivo. Cuando se inyectaron profilácticamente debajo de la piel de ratones, las vacunas DoriVac se acumularon en los ganglios linfáticos más cercanos donde estimularon las CD.
Una vacuna cargada con un antígeno de melanoma impidió el crecimiento de células de melanoma agresivas inyectadas posteriormente. Si bien todos los animales de control habían sucumbido al cáncer el día 42 del experimento, todos los animales protegidos con DoriVac estaban vivos.
Las vacunas DoriVac también inhibieron el crecimiento tumoral en ratones en los que la formación de tumores de melanoma ya estaba en marcha, con un espaciado de 3,5 nanómetros de 18 moléculas CpG proporcionando nuevamente efectos máximos sobre las células DC y T, y la reducción más fuerte en el crecimiento tumoral.
A continuación, el equipo preguntó si las vacunas DoriVac también podrían estimular las respuestas inmunitarias producidas por pequeños "neoantígenos" que emergen en los tumores de melanoma.
Los neoantígenos son objetivos ideales porque son producidos exclusivamente por células tumorales. Sin embargo, a menudo no son muy inmunogénicos, lo que hace que los adyuvantes altamente eficaces sean un componente importante de las vacunas neoantígenas. Una vacuna DoriVac personalizada con cuatro neoantígenos permitió a los investigadores suprimir significativamente el crecimiento del tumor en ratones que produjeron los neoantígenos.
Finalmente, los investigadores preguntaron si DoriVac podría crear sinergia con la terapia de puntos de control inmunológico, que reactiva las células T que han sido silenciadas en los tumores.
En ratones, las dos terapias combinadas dieron como resultado la regresión total de los tumores de melanoma y evitaron que volvieran a crecer cuando los animales fueron expuestos nuevamente a las mismas células tumorales cuatro meses después. Los animales habían desarrollado una memoria inmune del tumor. El equipo obtuvo una eficacia de vacunación similar en un modelo de linfoma en ratones.
"Creemos que el valor de DoriVac para determinar un punto óptimo en la administración de adyuvantes y mejorar la administración y los efectos de los antígenos acoplados puede allanar el camino hacia vacunas clínicas contra el cáncer más efectivas para su uso en pacientes con una variedad de cánceres", afirmó Zeng.>
Actualmente, el equipo está traduciendo la plataforma DoriVac hacia su aplicación clínica, lo que está respaldado por la evaluación del estudio de la distribución de la vacuna y los anticuerpos dirigidos a la vacuna en ratones, así como las citoquinas producidas por las células inmunes en respuesta a las vacunas in vivo.
"La plataforma DoriVac es nuestro primer ejemplo de cómo nuestra búsqueda de lo que llamamos Robótica Molecular (moléculas sintéticas bioinspiradas que tienen forma y función programables) puede conducir a terapias completamente nuevas y poderosas. Esta tecnología abre un camino completamente nuevo para el desarrollo de vacunas de diseño. con propiedades diseñadas para enfrentar desafíos clínicos específicos. Esperamos ver su rápida traducción a la clínica", dijo el director fundador del Wyss Institute, Donald Ingber, M.D., Ph.D.
Más información: Yang C. Zeng et al, Ajuste fino de la distribución espacial de CpG con origami de ADN para mejorar la vacunación contra el cáncer, Nature Nanotechnology (2024). DOI:10.1038/s41565-024-01615-3
Proporcionado por la Universidad de Harvard