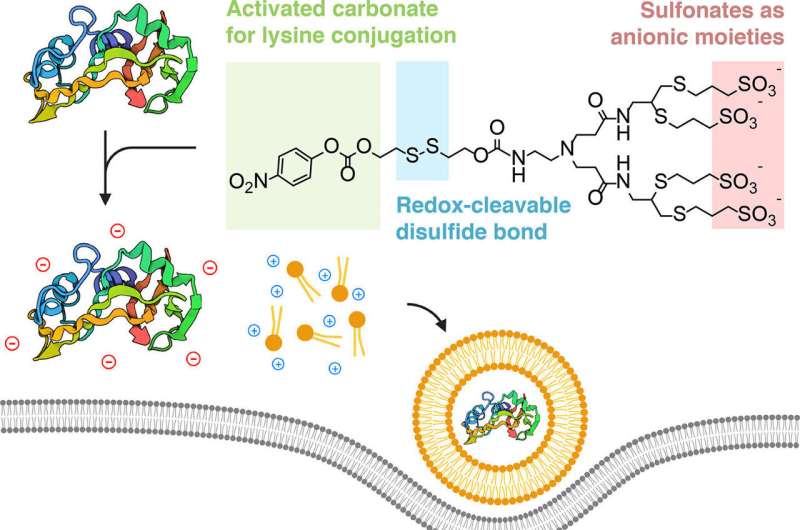
Una colaboración interdisciplinaria ha diseñado una forma de "ocultar" las proteínas para que puedan ser capturadas por nanopartículas lipídicas, que son similares a pequeñas burbujas de grasa. Estas burbujas son lo suficientemente pequeñas como para introducir su carga oculta en las células vivas, donde las proteínas se revelan y ejercen su efecto terapéutico.
Esta técnica generalizable podría conducir a la reutilización de miles de productos proteicos comerciales, incluidos anticuerpos, para investigación biológica y aplicaciones terapéuticas.
El artículo del grupo, "El encubrimiento aniónico biorreversible permite la entrega de proteínas intracelulares con nanopartículas lipídicas ionizables", publicado el 14 de mayo en ACS Central Science . El autor principal es el estudiante de doctorado Azmain Alamgir, que trabaja en los laboratorios de los coautores principales del artículo, Chris Alabi, profesor asociado de ingeniería química y biomolecular en Cornell Engineering, y Matt DeLisa, profesor de ingeniería William L. Lewis y director. del Instituto Cornell de Biotecnología.
El proyecto comenzó con un objetivo singular:combinar la experiencia del grupo DeLisa en el diseño de terapias basadas en proteínas con el enfoque del laboratorio Alabi en la administración intracelular de productos biológicos.
Para que algunos medicamentos afecten la biología de una célula y, en última instancia, traten una enfermedad, deben ingresar a la célula y llegar a un espacio específico. Esto es similar a arreglar una tubería rota en una casa:el plomero necesita acceder a una habitación concreta para reparar la fuga.
Las terapias basadas en proteínas tienen muchas virtudes (pueden tener efectos más específicos, con menor toxicidad y menor respuesta inmune), pero la facilidad de administración no es una de ellas. Las proteínas son grandes y engorrosas y no se difunden libremente hacia las células con tanta facilidad como lo hacen las moléculas pequeñas. Ésa es una de las razones por las que las moléculas pequeñas son la fuente predominante de fármacos en la industria farmacéutica:pueden difundirse fácilmente hacia las células sin un vehículo de administración.
A lo largo de los años, el grupo de DeLisa ha desarrollado una amplia gama de candidatos a fármacos proteicos interesantes y potencialmente eficaces. Desafortunadamente, la utilidad práctica de estas proteínas estuvo limitada por la ausencia de un método para su administración intracelular. Si bien la terapia génica (una tecnología biomédica que puede producir un efecto terapéutico al administrar un gen para su expresión en células diana) era una opción, el método tiene una historia accidentada debido a problemas de seguridad en humanos.
"Habíamos estado buscando una forma inteligente de introducir eficientemente nuestras proteínas diseñadas dentro de las células, especialmente en un contexto traslacional que no solo funcionaría en células cultivadas en laboratorio, sino que también sería eficaz y seguro en modelos animales y, eventualmente, en humanos. ", dijo DeLisa.
"Cuando Azmain conectó a nuestro grupo con el de Chris, una de las ideas que surgió fue:¿por qué administrar esto como una terapia genética cuando podemos administrarlo como una proteína ya producida? Y eso nos emocionó mucho".
El laboratorio de Alabi había enfrentado sus propios desafíos. Si bien el equipo tenía experiencia en la administración de ácidos nucleicos a las células utilizando nanopartículas, dijo Alabi, aún tenían que encontrar una manera de hacer lo mismo con las "proteínas blandas blandas y globulares" debido a la experiencia limitada del laboratorio en producir cantidades suficientes de proteínas para realizar pruebas.
"Vimos esto como un buen puente entre nuestros grupos de investigación, para crear este nuevo espacio en el que no creo que mucha gente estuviera trabajando en ese momento y hacerlo de una manera que pudiera ser escalable e impactante", dijo Alabi. .
Los investigadores tuvieron la idea general de utilizar un enfoque de bioconjugación que permitiría cargar las proteínas en nanopartículas lipídicas, que se forman alrededor de los ácidos nucleicos. Una gran ventaja de este enfoque fue que las nanopartículas lipídicas fueron un componente clave en las exitosas vacunas contra la COVID-19 desarrolladas por Pfizer-BioNTech y Moderna.
"En ese momento, esa tecnología realmente estaba despegando", dijo Alamgir.
Esas vacunas funcionaron entregando una carga útil en forma de ARN mensajero, que son ácidos nucleicos. Los investigadores ahora usarían el mismo concepto de administración de nanopartículas lipídicas (incluso los mismos materiales), pero con una carga útil de proteínas. El truco sería hacer que las proteínas se parezcan más a los ácidos nucleicos.
Los investigadores descubrieron que podían lograr esto "cubriendo" las proteínas con un ion cargado negativamente, para que se unieran electrostáticamente a los lípidos cargados positivamente.
"El quid de nuestra estrategia es conceptualmente muy simple", dijo Alamgir. "Estamos tomando proteínas y remodelando específicamente sus superficies con cargas negativas, para que parezcan ácidos nucleicos y puedan ensamblarse de manera similar en nanopartículas cuando se formulan con los lípidos característicos".
Una dificultad que encontró el equipo fue que las condiciones bajo las cuales se formulan los ácidos nucleicos para unirse o formar complejos con los lípidos son bastante duras, demasiado duras para las proteínas.
"Tuvimos que utilizar condiciones más suaves y una formulación ligeramente modificada a la que añadimos lípidos adicionales", dijo Alabi. "Así que, tanto desde el punto de vista de la bioconjugación de proteínas como desde el punto de vista de los lípidos, tuvimos que modificar la formulación para que funcionara tan bien".
El equipo, que incluía al estudiante de doctorado y coautor Souvik Ghosal, demostró con éxito el método de encubrimiento con compuestos sulfonados reactivos con lisina, matando células cancerosas con ribonucleasa A e inhibiendo la señalización tumoral con anticuerpos monoclonales de inmunoglobulina G (IgG).
Un beneficio adicional de la química de bioconjugación utilizada por el equipo es que el proceso es reversible. La etiqueta química que se agrega a la proteína se desprende una vez que ingresa al citoplasma de la célula. Y debido a que el método de bioconjugación se dirige a la lisina (un tipo de aminoácido que se encuentra en abundancia en las proteínas naturales), la técnica se puede replicar para prácticamente cualquier proteína.
"Esto tiene potencial para tomar muchas proteínas disponibles en el mercado que actualmente están disponibles en muchos distribuidores de ciencias biológicas y compañías de biotecnología y reutilizarlas para nuevas aplicaciones intracelulares", afirmó Alamgir.
Más información: Azmain Alamgir et al, El encubrimiento aniónico biorreversible permite la entrega de proteínas intracelulares con nanopartículas lipídicas ionizables, ACS Central Science (2024). DOI:10.1021/acscentsci.4c00071
Información de la revista: Ciencia central de ACS
Proporcionado por la Universidad de Cornell