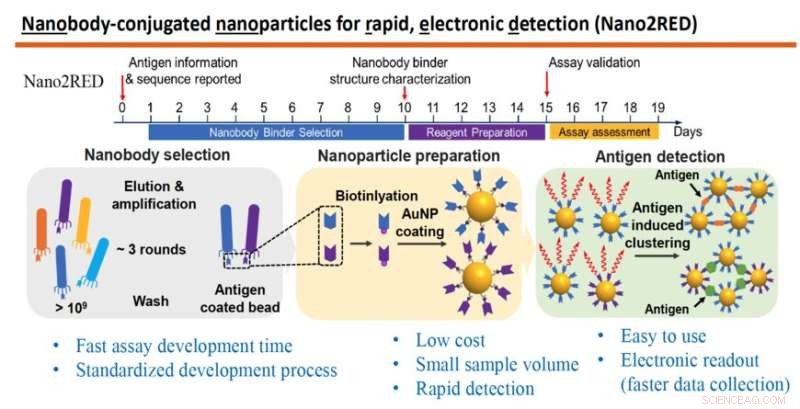
El gráfico destaca las características clave de Nano2RED, un método de diagnóstico innovador inventado por el profesor Wang y sus colegas. La sección superior ilustra la línea de tiempo rápida de los pasos para la producción de la prueba, que se puede llevar a cabo en aproximadamente 20 días. La sección central del gráfico muestra los pasos básicos involucrados. En primer lugar, se produce una gran biblioteca de anticuerpos sintéticos o nanocuerpos y se examina contra un antígeno conocido (izquierda), luego, los nanocuerpos se unen a nanopartículas de oro (centro) y, por último, se detectan antígenos de enfermedades en una muestra cuando se fusionan nanocuerpos unidos a nanopartículas de oro. con ellos, produciendo un resultado positivo en la prueba (derecha). Crédito:laboratorio Wang
En los últimos años, han surgido enfermedades infecciosas mortales, como el ébola y la COVID-19, que han causado una devastación humana generalizada. Aunque los investigadores han desarrollado una variedad de métodos sofisticados para detectar tales infecciones, los diagnósticos existentes enfrentan muchas limitaciones.
En un nuevo estudio, Chao Wang, investigador del Instituto de Biodiseño y la Escuela de Ingeniería Eléctrica, Informática y Energética de la Universidad Estatal de Arizona, junto con colegas de ASU y colaboradores de la Universidad de Washington (UW), Seattle, describen un método novedoso para detectar virus como Virus del Ébola (EBOV) y SARS CoV-2.
La técnica, conocida como Nano2RED, es un giro inteligente en las pruebas convencionales de alta precisión que se basan en protocolos de prueba complejos y costosos sistemas de lectura. Los nanosensores en solución ("Nano2" en el nombre) sirven para detectar antígenos de enfermedades en una muestra mediante una simple mezcla. El innovador proceso de lectura rápida y electrónica ("RED") desarrollado en el laboratorio de Wang ofrece resultados de prueba, que son detectables como un cambio de color en la solución de muestra, y registra los datos a través de elementos semiconductores económicos como LED y fotodetectores.
La tecnología representa un avance significativo en la lucha contra las enfermedades infecciosas. Puede desarrollarse y producirse a un costo muy bajo, implementarse en semanas o días después de un brote y estar disponible por alrededor de 1 centavo por prueba.
En comparación con las pruebas de laboratorio de alta precisión ampliamente utilizadas, como ELISA, Nano2RED es mucho más fácil de usar. No requiere incubación o lavado de la superficie, marcaje con tinte o amplificación, y aun así proporciona una sensibilidad 10 veces mejor que ELISA. Además, el uso de dispositivos semiconductores admite un sistema de lectura digital altamente portátil, que se puede desarrollar y producir a un costo tan bajo como unos pocos dólares, lo que lo hace ideal no solo para uso en laboratorio sino también para clínicas, uso doméstico y control remoto o lugares con escasez de recursos. Este enfoque se basa en diseños modulares y podría usarse potencialmente para probar cualquier patógeno.
"Esta tecnología no funciona porque sea compleja sino porque es simple", dice el profesor Wang. "Otra característica única es la naturaleza multidisciplinaria de la biodetección. Una comprensión fundamental de la bioquímica, la fluídica y la optoelectrónica nos ayudó a idear algo así de 'simple'".
Wang es investigador del Centro de Biodiseño para Diseño Molecular y Biomimética en ASU. También es investigador en la Escuela de Ingeniería Eléctrica, Informática y Energética de ASU; y el Centro de Innovación Fotónica. El Dr. Liangcai Gu es colaborador del Departamento de Bioquímica y el Instituto de Diseño de Proteínas de la UW, Seattle.
La investigación aparece en el número actual de la revista Biosensors and Bioelectronics . El Dr. Xiahui Chen y Md Ashif Ikbal de ASU y el Dr. Shoukai Kang de UW son los primeros autores, y Jiawei Zuo y Yuxin Pan son los otros autores contribuyentes.
El cuello de botella de las pruebas
Los epidemiólogos conocen desde hace mucho tiempo la fórmula básica a la hora de enfrentarse a un brote de enfermedad. Para identificar casos y detener el contagio, es necesario desarrollar una prueba o ensayo preciso que pueda identificar la enfermedad, luego realizar pruebas tempranas y frecuentes para evaluar la tasa de propagación e intentar aislar a los infectados.
Desafortunadamente, cuando se ha desarrollado, fabricado y distribuido un nuevo diagnóstico, el brote de la enfermedad a menudo ya está muy extendido y es difícil de contener. Además, las pruebas precisas, incluida la PCR (que puede amplificar niveles diminutos de ácidos nucleicos patógenos a niveles mensurables), suelen ser costosas, laboriosas y requieren instalaciones de laboratorio sofisticadas.
La epidemia de ébola de 2014-2016, aunque se limitó en gran medida a África occidental, se propagó a una velocidad aterradora, provocó el pánico y mató a más de 11 000 personas. La tasa de letalidad del virus, una de las más altas para cualquier patógeno conocido, puede superar el 90%, dependiendo de la cepa de la enfermedad. La crisis se vio exacerbada por una combinación de sistemas de vigilancia inadecuados y una infraestructura de salud pública deficiente.
El SARS CoV-2, aunque menos letal que el ébola, se ha extendido a todos los países del mundo y ya ha matado a más de 5,6 millones de personas en todo el mundo. En ambos brotes de enfermedades, las pruebas de diagnóstico llegaron tarde a la escena. Además, los requisitos de prueba costosos y engorrosos han significado que se han administrado muy pocas pruebas, incluso después de su desarrollo exitoso.
El nuevo estudio aplica su método innovador para evaluar estas dos enfermedades prominentes como prueba de concepto.
Maremoto
Una característica común en muchos brotes de enfermedades es la velocidad vertiginosa con la que un patógeno, después de haber infectado primero a un puñado de personas, puede cobrar impulso, expandirse en todas las direcciones y abrumar rápidamente a los hospitales y proveedores de atención médica. Cutting off a pathogen's routes of transmission requires identifying and isolating sick individuals through testing, as quickly as possible.
During a pandemic like COVID-19, the sensitivity of a given diagnostic test is secondary to how often the test is given and how long it takes for results to be processed. A highly sensitive test is of limited use if it can only be given once, and results require a weeks-long turnaround. Research has shown that infection outbreaks are best controlled when testing is repeated in less than 3-day intervals and at a large scale.
Adequately preparing society for current and future outbreaks of infectious disease will require faster, cheaper, more accurate and more easily usable diagnostics.
Close affinity
The new technology can identify secreted glycoprotein (sGP), a telltale fingerprint of Ebola virus disease and the SARS-CoV-2 spike protein receptor binding domain (RBD). The technology is highly accurate, rivaling ELISA, a long-recognized gold standard technology for diagnostic testing.
The basic idea of such diagnostics, known as immunoassays, is simple:A sample of blood (or other biological fluid) is applied to the assay, which is adorned with antibodies. When antibodies recognize the presence of a corresponding disease antigen in the sample, they bind with it, producing a positive test result. In the ELISA test, the disease antigen needs to be immobilized on a flat surface.
Nano2RED also relies on binding affinity for positive diagnosis but instead uses floating gold nanoparticles for readout. Unlike ELISA, Nano2RED can be developed from scratch in roughly 10 days and theoretically applicable for any pathogen, providing vitally important early surveillance in the case of a disease outbreak. It can deliver test results in 15-20 minutes and may be administered at an estimated cost of a penny per test. In the current study, the new test was shown to detect Ebola's sGP in serum with a sensitivity roughly 10 times better than ELISA.
Sensing danger
In this method, the first step is to produce a very large library containing over a billion random amino acid sequences, known as nanobodies, which can act as synthetic antibodies, able to bind with target disease antigens. This vast library of nanobodies is then successively screened against the antigen in question, for example, sGP in the case of Ebola. Only those nanobodies that show strong binding affinity for the antigen are used for sensing.
Next, the selected nanobodies are affixed to gold nanoparticles that will act as probes to identify and bind with antigens present in a blood sample. In the study, a pair of two high affinity nanobodies were selected and attached to gold nanoparticles. This approach improves both the sensitivity and specificity of the test.
The key innovation of Nano2RED is the way the antigen detection is registered. As disease antigens in the sample are recognized by the nanobodies, they bind together, forming clusters of bound nanobody and antigen, like islands of algae floating on the sea surface. "Basically, an antigen works like superglue to bring the nanoparticle together," Wang says.
A 'golden' opportunity in the fight against infectious disease
The gold nanoparticles provide a stable platform to hold the nanobodies in place. Once enough binding has taken place, the bound clusters begin to sink to the bottom of the vessel. This can be detected with the naked eye in the form of a color change. The solution becomes lighter in color as the gold-nanoparticle-carried antigen-antibody clusters precipitate out, signaling detection of the pathogen.
While full precipitation of nanoparticle clusters leading to a test result can normally take several hours, the process can be sped up by centrifuging the sample, which eliminates the wait time for precipitation. In this case, just 15-20 minutes are sufficient for a result. "Of course, the gold nanoparticles are heavy, and that helps quick sedimentation, too." Wang added.
Gold nanoparticles also work to display color, not yellow but red, by absorbing light from a narrow spectral range. This absorbance feature allowed the Wang lab to invent a tiny, inexpensive device that converts this color change into an electrical signal, using color-matching semiconductor LEDs and photodetectors. Such instruments produce a rapid and accurate readout of assay results, whose limits of detection are comparable to or better than costly lab-based spectroscopy methods.
The test also delivers quantitative results based on amount of antigen detected. This could be vitally useful for estimating disease severity as well as time elapsed since the infection event. In the future, the test results can be digitized by circuits and conveniently transmitted via internet to anywhere in the world for data analysis and further scrutiny, which could be important to government policy decision-making processes and timely interruption of the transmission.
Nano2RED requires only a tiny blood sample, typically around 20 microliters. "This also makes gold inexpensive in our case, because the mount we need is so tiny," Wang said. Unlike conventional methods, Nano2RED is also very simple to use with minimal training involved for healthcare personnel. It does not require any time-consuming and expensive incubation, washing, fluorescent labeling or amplification.
Future research will help improve the assay's limits of detection even further and modify its detection capacities to include virion particles, extracellular vesicles, small molecules, and nucleic acids.
"There is certainly still a lot to explore," Wang added, "but we so far have a happy marriage between engineering disciplines and biology. And that is what we will continue to work on." Development of home COVID-19 test comparable to PCR accuracy, selectivity