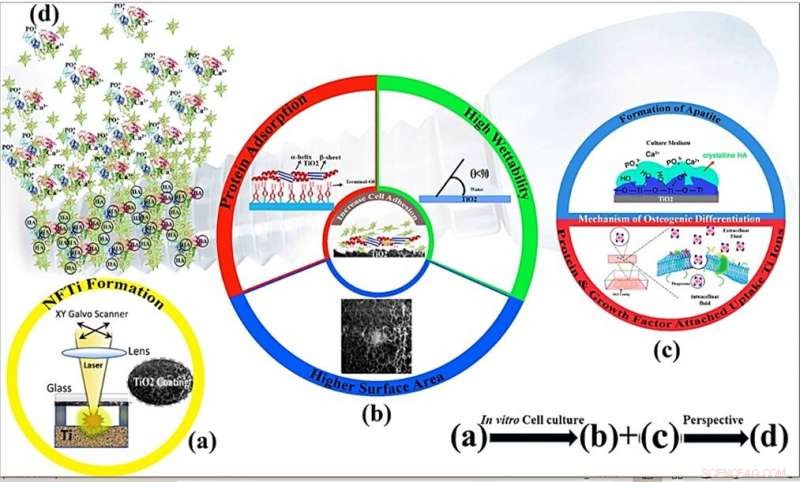
Mecanismos esquemáticos de proliferación celular y osteoinductividad del recubrimiento de titanio nanofibroso mediante modificación de la superficie mediante transferencia inversa inducida por láser de alta intensidad (HILIRT):un método de deposición novedoso. (a) Capa de NFTi depositada sobre vidrio mediante la técnica HILIRT propuesta a velocidades de exploración del rayo láser. b) La biocompatibilidad del titanio como material de implante se atribuye a la formación espontánea del óxido superficial en el aire y / o en los fluidos fisiológicos. y se cree que los comportamientos celulares, p.ej., adhesión, la propagación y la proliferación se ven muy afectadas por 1. Área de superficie 2. Mojabilidad 3. Grupos hidroxilo de superficie (Los grupos de hidroxilo de superficie del terminal OH- regulan los comportamientos iniciales de adsorción de proteínas). (c) Los grupos hidroxilo de la superficie y las nanopartículas de Ti bioactivas promueven la diferenciación de los osteoblastos a través de 1. Los grupos Ti-OH formados en la superficie del titanato después de remojarlo en un medio de cultivo osteogénico están cargados negativamente. y por lo tanto se combinan selectivamente con los iones Ca2 + cargados positivamente en el fluido para formar eventualmente fosfato de calcio. 2. Biocomplejos (iones, proteína y factor de crecimiento) son internalizados por endocitosis mediada por caveolas. (d) Perspectiva:formación y remodelación ósea alrededor de los materiales implantados. Crédito:Informes científicos, doi:10.1038 / s41598-019-54533-z
En un nuevo estudio publicado en Informes científicos , Mohammad-Hossein Beigi y un equipo de investigación de los departamentos de Ingeniería y Ciencias Aplicadas y Biotecnología Celular en Canadá e Irán describieron un nuevo método para formar biomateriales biocompatibles para la ingeniería de tejidos óseos. Diseñaron como una web, Recubrimientos nanofibrosos de titanio tridimensionales (3-D) que utilizan transferencia inversa inducida por láser de alta intensidad (HILIRT). El equipo demostró por primera vez el mecanismo de ablación y deposición de titanio (Ti) sobre sustratos de vidrio utilizando múltiples pulsos de láser de picosegundos en el aire ambiental para comparar las predicciones teóricas con los resultados experimentales. Examinaron el rendimiento de muestras de vidrio desarrolladas al recubrir estructuras nanofibrosas de titania a través de variadas duraciones de pulso láser. utilizando métodos como la microscopía electrónica de barrido (SEM).
Para comprender las interacciones entre la superficie del nuevo material y las células biológicas, Beigi y col. exploró las interacciones de las células madre mesenquimales derivadas de huesos humanos (BMSC) cultivadas en los nuevos biomateriales. Para esto, utilizaron una variedad de pruebas en el laboratorio, incluido un método colorimétrico para comprender la actividad metabólica celular (ensayo MTS), inmunocitoquímica, análisis de adsorción y absorción de proteínas. Los resultados mostraron una biocompatibilidad significativamente mejorada en muestras tratadas con láser en comparación con sustratos no tratados. Beigi y col. modificó su técnica HILIRT al disminuir la duración del pulso y generar nanofibras de titania con estructuras más densas durante la ingeniería de materiales avanzada. Según sus hallazgos, La densidad de nanoestructuras y la concentración de nanofibras recubiertas jugaron un papel crítico para generar bioactividad en las muestras tratadas al inducir la diferenciación temprana de BMSC (células madre mesenquimales derivadas de hueso) para formar tejido óseo a través de diferenciación osteogénica (formación de hueso).
Los bioingenieros están desarrollando rápidamente nuevas técnicas de ingeniería de tejido óseo (BTE) para la regeneración ósea; para mejorar los "estándares de oro" existentes de los métodos de autoinjerto y aloinjerto óseo en la medicina regenerativa. Las desventajas de las técnicas existentes incluyen morbilidad en el sitio donante y suplementos de nutrientes limitados durante la regeneración ósea. La ingeniería de tejido óseo (BTE) es una dirección de investigación prometedora para facilitar el crecimiento y la reparación ósea, incluso en defectos esqueléticos a gran escala. Los investigadores tienen como objetivo utilizar células madre con BTE debido a sus capacidades de autorrenovación junto con la diferenciación de células madre. para formar una variedad de tipos de tejidos. Dado que las propiedades físicas y químicas de la superficie de un material pueden influir en la viabilidad de las células madre mesenquimales humanas (hMSC) para la auto-restauración, diferenciación y proliferación. Por lo tanto, los materiales y las células pueden trabajar juntos en aplicaciones de BTE para proporcionar una plataforma deseada para la osteointegración durante la remodelación ósea.
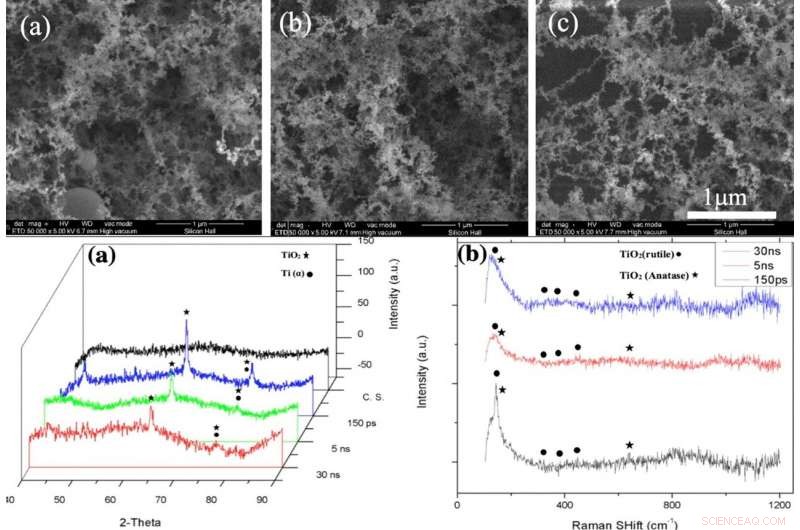
ARRIBA:Imágenes SEM de la capa NFTi (Nanofibrous Titania) con potencia =10 W, frecuencia =600 KHz (a) duración del pulso =150 ps, (b) duración del pulso =5 ns, (c) duración del pulso =30 ns con aumento de 50000X. INFERIOR:(a) patrón XRD, (b) Espectro Raman de vidrio desnudo y muestras recubiertas de titania con diferentes duraciones de pulso (creado por Origin Pro 2019B (GF3S4-3089-7907079) https://www.originlab.com/). Crédito:Informes científicos, doi:10.1038 / s41598-019-54533-z.
Los equipos de investigación habían utilizado previamente varias técnicas para producir superficies de material BTE, incluido sol-gel, hidrotermal 106, electrohilado e impresión 3D; sin embargo, seleccionar un método ideal sigue siendo un desafío. Por ejemplo, Los biomateriales artificiales deben interactuar sin esfuerzo con los fluidos fisiológicos y asimilarse con los tejidos circundantes duros y blandos para mantener la actividad celular y lograr una biocompatibilidad superior. Los científicos de materiales y bioingenieros habían utilizado titanio y sus aleaciones para implantes ortopédicos, permitiendo la osteogénesis basada en nanopartículas de titanio (NP) de células madre de la pulpa dental y células madre derivadas de tejido adiposo. Los métodos de modificación de la superficie con láser pueden modificar las superficies del material para mejorar la biocompatibilidad de la superficie; donde el método HILIRT había mostrado previamente potencial para diseñar componentes de laboratorio en un chip y otros biomateriales biocompatibles. Los científicos pueden alterar los parámetros del láser para manipular las superficies de los materiales para ayudar a la diferenciación celular.
En el presente trabajo, Beigi y col. investigó los efectos de la duración del pulso láser en las superficies de los materiales utilizando el método HILIRT y probó el comportamiento biológico de los biomateriales sintéticos mediante la caracterización de materiales y las pruebas biológicas en el laboratorio. Investigaron el contacto entre el material celular y las superficies materiales mediante la expresión génica, estudios de mineralización e interacción de proteínas. Los científicos desarrollaron una película delgada de titania nanofibrosa (NFTi) y la empaparon en fluido corporal simulado (SBF) para formar estructuras de capas similares a hidroxiapatita (HA) e identificaron las modificaciones de la superficie del material utilizando el ángulo de contacto del agua (CA), microscopía electrónica de barrido (SEM), análisis de espectroscopía de rayos X de energía dispersiva (EDS), espectroscopias de micro-Raman y difracción de rayos X (XRD).
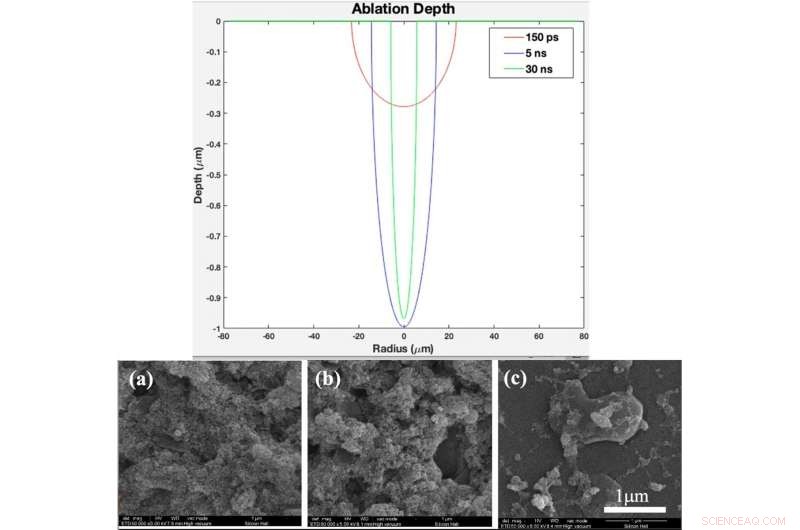
ARRIBA:Perfil de profundidad de ablación teórico en función del radio para una duración de pulso de 150 ps, 5 ns, y 30 ns (creado en el software MATLAB R2015b (9.6.0.1072779) https://www.mathworks.com). INFERIOR:(a) patrón XRD, (b) Espectro Raman de vidrio desnudo y muestras recubiertas por titania con diferentes duraciones de pulso después de 2 días de inmersión en SBF, (c) patrón XRD, (d) Raman spectrum of bare glass and samples coated by titania with different pulse duration after 4 days immersion in SBF Fig. 4. (a). XRD pattern, (b) Raman spectrum of bare glass and samples coated by titania with different pulse durations (created by Origin Pro 2019B (GF3S4-3089-7907079) https://www.originlab.com/). Crédito:Informes científicos, doi:10.1038/s41598-019-54533-z.
They deposited NFTi (nanofibrous titania) structures at different pulse durations to form laser nanofiber coated smooth surfaces and tested the chemical and physical composition of the resulting advanced materials. When they decreased pulse duration, the titanium weight percentage increased, and the scientists observed the temperature of the irradiated zone to be significantly higher for a shorter pulse duration of 150 picoseconds (ps) compared with 5 nanoseconds (ns) and 30 ns. The decreased pulse duration transmitted power to the target in a shorter time, causing the heat affected zone (HAZ) to have a higher temperature, allowing a denser plasma plume to form more NFTi structures on a glass substrate. Decreasing the laser pulse duration created more biocompatible Ti nanofibers with a higher content of HA(hydroxyapatite)-like substance sedimentation on the samples.
Using phase-contrast microscopy images of fibroblast-like BMSCs on titania-coated glass surfaces, Beigi et al. observed normal cell morphology. They measured water contact angles of droplets of water on the material specimens and conducted cytotoxicity tests with MTS assays on stem cells grown on NFTi coatings. The materials coated with NFTi for 150 ps showed the highest absorbance rate (known as the S1 group) with subsequently high rates of cell viability, cell adhesion and metabolic activity. When the researchers used immunofluorescent staining to observe cell migration, the S1 sample (with NFTi coating for 150 ps) showed higher rates of cell migration. To confirm stem cell (BMSC) differentiation, the scientists investigated osteogenic-related gene expression with RUNX2, collagen I, osteopontin and osteonectin genes, using quantitative qRT-PCR. Entre las muestras, S1 samples indicated significantly higher relative expression for all osteogenic-related genes.
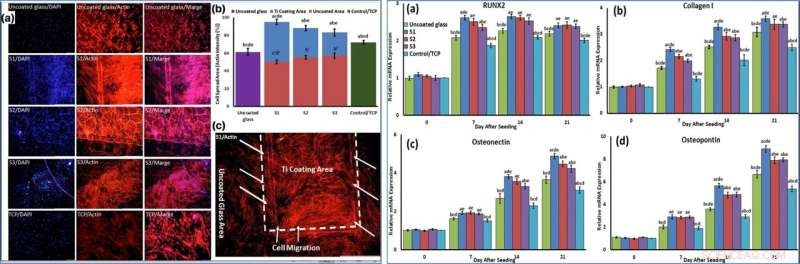
LEFT:Cells were stained by phalloidin to observe (a, c) and quantify (b) actin filament expansion and migration in all samples after 7 days. The first column in A is DAPI nuclear staining (blue), second column, phalloidin labelled F-actin (red), and third column, overlaid fluorescent image of immunostained cellular components (merge:DAPI/F-actin). The red bars in B indicate the intensity percentage of actin filament on the glass in S1, S2, and S3 samples and the blue bars describe the intensity percentage of actin filament the NFTi coated area. (c) Higher magnification of BMSCs migration from glass area toward Ti coating area in S1. RIGHT:The mRNA relative expression levels of osteogenic genes included Runx2 (a), Collagen I (b), Osteonectin (c), and Osteopontin (d) determined by qRT-PCR for all samples. Crédito:Informes científicos, doi:10.1038/s41598-019-54533-z.
To confirm mineralization, the scientists used alizarin red followed by soluble Ca nodules color absorbance quantification, to observe high levels of mineralization on all samples on days seven and 14. The team investigated surface protein absorption potential, protein-ion biocomplex formation and biocomplex cell uptake to demonstrate highest levels of protein-ion biocomplex formation on the S1 samples.
De este modo, Mohammad-Hossein Beigi and colleagues used the HILIRT method to achieve high surface bioreactivity, osteogenesis and osseointregration of NFTi-BMSCs. The surface character of the new materials allowed protein and biomolecule interactions to stimulate cell adhesion, mineralization and osteogenesis for faster and more suited osseointegration in vivo and in vitro. The scientists engineered nanofiber mesh-like scaffolds using titanate to allow vascularization, protein attachment, cell proliferation and cell attachment on the substrate. Such microporous surfaces can promote nutrition diffusion, vascularization and blood flow due to improved biomechanical strength. Además, the hydrophilic surface property; verified using water contact angle measurements, facilitated cell-ECM adhesion to improve cell binding and vigorous tissue growth.
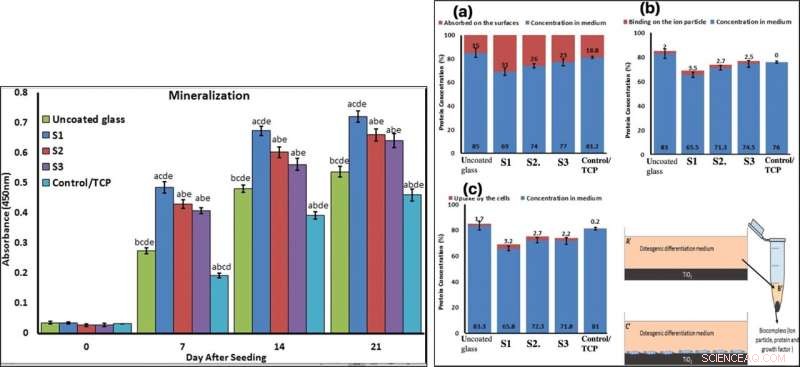
LEFT:Confirmation of osteogenic differentiation and matrix mineralization of BMSCs by quantifying alizarin red staining. RIGHT:Protein adsorption and biocomplex adsorption/absorption:concentration of protein in osteogenic differentiation medium after 6 hours of immersion (a); concentration of protein in osteogenic differentiation medium after 6 hours of immersion and then centrifuged at 14, 000 rpm for 30 min (b); concentration of protein in osteogenic differentiation medium after 6 hours of immersion with cell culture (c). Crédito:Informes científicos, doi:10.1038/s41598-019-54533-z.
The S1 sample (NFTi, 150 ps) developed in this work generated the best surface bioreactivity for bone regeneration or bone replacement. Beigi et al. showed the advantages of using titania as an orthopedic implant material and the surface modification strategies implemented in the study improved surface bioreactivity and osteogenesis for assisted bone tissue development. The cost-effective frugal method can provide a metallic nanofiber structure surface to be coated on multiple surfaces for varied biomedical applications. The proposed technique (combining materials engineering with stem cells) will open new doors to engineer advanced biomaterials with enhanced surface bioreactivity for improved biocompatibility in vitro and in vivo. The findings demonstrate beneficial effects of an experimental scaffold in the lab with potential for medical osseointegration as a BTE implant.
© 2019 Science X Network