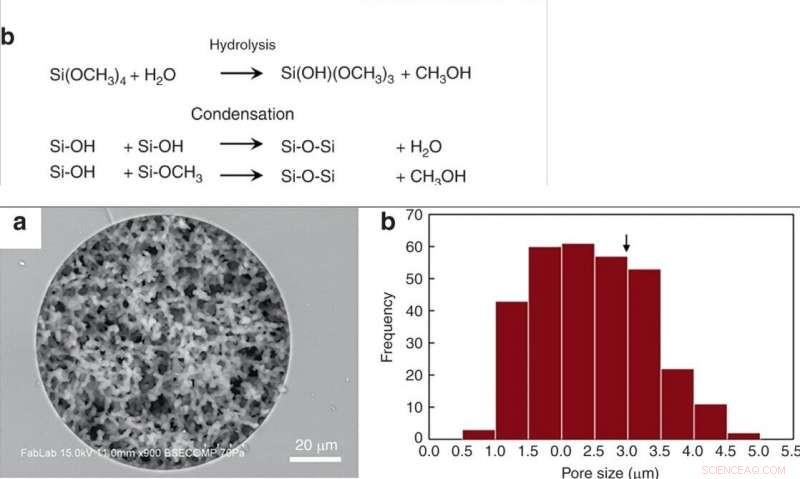
ARRIBA:(a) Síntesis de un monolito de sílice poroso en un capilar de sílice fundido y un molde termoplástico mediante la química sol-gel. (b) Reacciones competitivas durante la síntesis de monolito. Los grupos silanol presentes en el capilar de vidrio forman enlaces covalentes con el monolito durante este paso. INFERIOR:(a) Imagen SEM de un monolito de sílice sintetizado dentro de un capilar de sílice fundida de 100 μm de DI, revelando una porosidad uniforme y un excelente anclaje a la pared del monolito. (b) Histograma del tamaño de los poros. El diámetro crítico para la hemólisis de glóbulos rojos (2r *) está marcado con una flecha. Crédito:Microsistemas y Nanoingeniería, doi:10.1038 / s41378-019-0063-4
Los diagnósticos unicelulares emergentes se basan en el potencial para aislar de manera rápida y eficiente las bacterias de matrices biológicas complejas. En un estudio reciente ahora publicado en Microsistemas y nanoingeniería , Jung Y. Han y colegas de los Departamentos interdisciplinarios de Ingeniería Mecánica, La ingeniería química biomolecular y la bioingeniería en los EE. UU. Desarrollaron un dispositivo para aislar bacterias intactas y viables de la sangre completa utilizando un microfluídico, monolito de sílice poroso. Lograron la hemólisis mecánica al tiempo que proporcionaban el paso de bacterias intactas y viables a través de los monolitos para el aislamiento bacteriano basado en el tamaño y la lisis selectiva. Han y col. describió un proceso para sintetizar grandes cantidades de elementos monolíticos unidos por capilares discretos y ladrillos monolíticos de escala milimétrica para integrarlos en chips de microfluidos.
Exploraron el impacto de la morfología monolítica, geometría y condiciones de flujo en la lisis celular y regímenes de flujo que permitieron la lisis celular selectiva y el paso selectivo de múltiples bacterias gram negativas y gram positivas. La técnica empleada por Han et al. permitió la preparación rápida de muestras y el análisis bacteriano cuando se combinó con espectrometría Raman de celda única. El trabajo proporciona pasos únicos de preparación de muestras para respaldar el análisis bacteriano rápido y sin cultivo para aplicaciones en dispositivos biomédicos en el punto de atención.
Las bacterias en la sangre pueden provocar sepsis, Infección de tejidos y otras afecciones médicas graves. que requiere la identificación temprana de bacterias transmitidas por la sangre para un tratamiento eficaz. La capacidad de identificar bacterias rápidamente mediante el diagnóstico en el lugar de atención puede mejorar en gran medida el potencial clínico para un tratamiento óptimo durante la etapa inicial de la infección. El estándar de oro existente para la caracterización bacteriana se basa en el análisis de cultivos de células fenotípicas y requiere al menos 24 horas para recolectar muestras para cultivo y análisis en un laboratorio de microbiología clínica y de diagnóstico. La técnica existente es sólida y económica, pero no puede generar resultados oportunos para guiar las etapas iniciales del tratamiento.
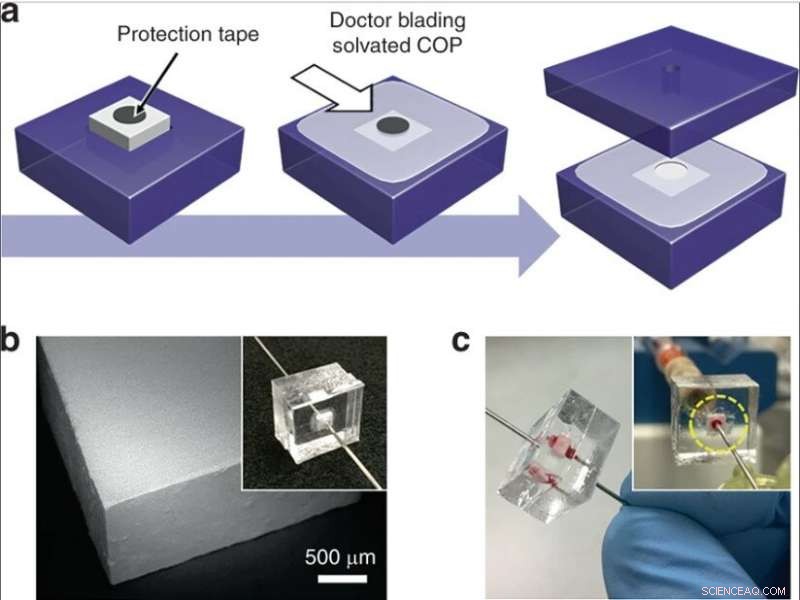
(a) Integración de un ladrillo monolítico de sílice en un chip termoplástico. Se coloca una cinta circular sobre un monolito insertado en un sustrato COP, y se aplica COP solvatado a la superficie expuesta. Después de un secado parcial, se quita la cinta, el dispositivo está encerrado por otro sustrato COP, y los puertos de fluido se insertan en los orificios que proporcionan una ruta de flujo a través del monolito. (b) Imagen SEM de un ladrillo monolito cortado con una sierra para cortar obleas. (c) Imagen de un dispositivo durante la perfusión de sangre total. Crédito:Microsistemas y Nanoingeniería, doi:10.1038 / s41378-019-0063-4
En el presente trabajo, Han y col. exploraron dispositivos de microfluidos integrados con monolitos de sílice porosa como elementos simples de flujo continuo para el análisis selectivo de células sanguíneas y el aislamiento intacto de bacterias. Los monolitos son materiales altamente porosos compuestos de morfología de células abiertas con trayectorias retorcidas de flujo de fluidos. Los científicos pueden controlar la morfología de los poros monolíticos mediante una alta tensión superficial mecánica durante la perfusión celular para la hemólisis mecánica de las células sanguíneas. al tiempo que permite que las bacterias intactas y viables viajen por las sinuosas rutas de flujo para su aislamiento sin cultivo. Han y col. utilizó el método de paso selectivo de bacterias en sangre total en condiciones de flujo para especies gram positivas y gram negativas, a pesar de las diferencias de las cepas bacterianas. La técnica de lisis selectiva de monolitos de alto rendimiento combinada con potentes métodos analíticos como la espectroscopia Raman puede permitir el análisis sin cultivo de bacterias en sangre completa a nivel de una sola célula.
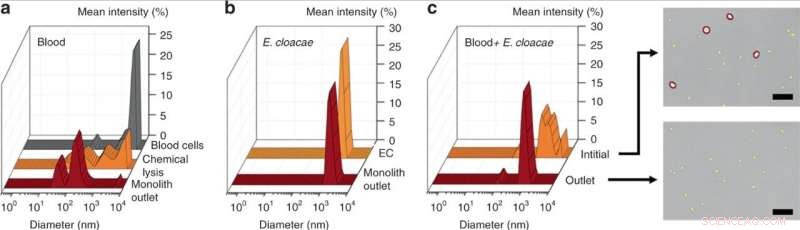
Medición DLS de (a) sangre inicial diluida 25 ×, sangre químicamente lisada, y sangre lisada por perfusión a través del dispositivo monolito, revelando una reducción significativa en el tamaño de los desechos celulares para la lisis mecánica de monolitos sobre la lisis química. (b) Medición DLS de E. cloacae suspendida en 1 × PBS, y muestra perfundida a través del dispositivo monolito, no muestran cambios en el tamaño de las bacterias. (c) Medición DLS de sangre diluida 100 × enriquecida con E. cloacae, y muestra recogida de la salida de un monolito poroso. El pico ancho en la muestra de entrada indica una población mixta de células sanguíneas y células bacterianas pequeñas, mientras que la muestra de salida mostró una reducción significativa en células grandes (> 2 µm), como se confirma en las imágenes ópticas. Barras de escala =25 µm. Crédito:Microsistemas y Nanoingeniería, doi:10.1038 / s41378-019-0063-4
Han y col. procesos de síntesis de monolitos de sílice modificados previamente informados, seguido de hidrólisis y condensación de sílice para formar vidrio de sílice a bajas temperaturas. Para preparar el monolito de sílice, los científicos utilizaron una solución precursora compuesta de silicatos de alquilo, polietilenglicol (PEG) como porógeno, urea como fuente de iones hidroxilo para minimizar la heterogeneidad y ácido acético. Cuando optimizaron el proceso sintético, los monolitos resultantes eran homogéneos y estaban bien anclados a las paredes capilares de sílice. Los científicos midieron el grosor de la estructura del monolito esquelético final y calcularon su permeabilidad utilizando cromatografía líquida de alta resolución para controlar las condiciones experimentales. Para minimizar la variación intrínseca, Han y col. corte los tubos capilares resultantes en segmentos de 5 cm de largo para probar la permeabilidad antes de usarlos.
Luego desarrollaron dos métodos complementarios para operaciones de bajo y alto rendimiento para integrar monolitos de sílice en sistemas de microfluidos. Para permitir una operación de bajo rendimiento, los científicos incorporaron segmentos capilares que contienen monolitos dentro de chips de microfluidos termoplásticos para proteger el monolito durante la integración. Para una lisis selectiva de alto rendimiento, utilizaron monolitos con áreas de sección transversal más grandes dentro de los dispositivos de microfluidos. El método completo de fabricación proporcionó una excelente confiabilidad para un funcionamiento sin fugas durante la perfusión de sangre total.
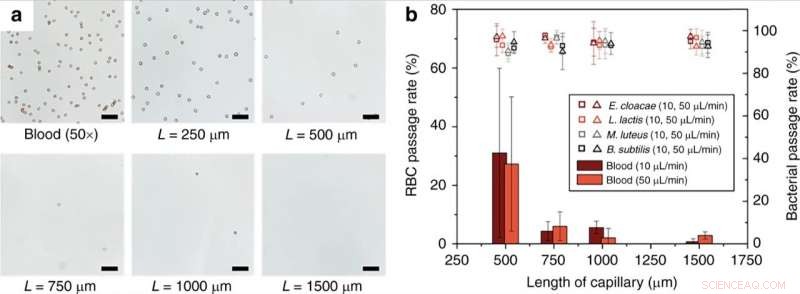
(a) Dependencia de la longitud del monolito de la hemólisis de RBC. Totalmente, Se perfundió sangre diluida 50x en PBS 1x a través de monolitos capilares de varias longitudes a un caudal de 10 µl / min. (b) Tasa de paso de RBC y bacterias viables a diferentes tasas de flujo y longitudes de capilar que contiene monolitos. Barras de escala =50 µm. Las barras de error son ± 1SD. El contraste de las imágenes ópticas se ajustó para mejorar la visibilidad. Crédito:Microsistemas y Nanoingeniería, doi:10.1038 / s41378-019-0063-4
Como prueba de principio, Han y col. Enterobacter cloacae seleccionado (gramnegativo, bacterias en forma de varilla) para explorar su eficacia de paso, junto con tres bacterias grampositivas; Lactococcus lactis, Micrococcus luteus y Bacillus subtilis. Durante los experimentos, perfundieron soluciones bacterianas a través de monolitos de microfluidos con diferentes geometrías y condiciones de flujo para probar el paso de bacterias y la lisis de células sanguíneas mediante dispersión dinámica de luz (DLS). Por ejemplo, la perfusión de E. cloacae purificada a través del monolito no produjo cambios perceptibles en los picos de DLS, indicando el paso intacto de bacterias.
Los científicos demostraron el efecto de la longitud del dispositivo monolítico poroso sobre la eficiencia de la lisis de glóbulos rojos (RBC). Los resultados indicaron que la eficacia de la lisis de RBC aumentó significativamente para longitudes de monolito por encima de 1 mm. Han y col. también estudió el destino de los glóbulos blancos (WBC) durante el funcionamiento del dispositivo monolito, las células no podrían atravesar el monolito sin ser lisadas de manera similar a los glóbulos rojos. Técnicamente, Los glóbulos rojos se deformaron a una forma discoide para pasar a través del monolito, lo que provocó un aumento significativo de la tensión de la membrana para dar como resultado la lisis de los glóbulos rojos. Relativamente, Las células bacterianas tenían dimensiones similares a los poros del monolito y, por lo tanto, requerían menos expansión de la pared celular para un paso exitoso sin ruptura. Los científicos optimizaron los parámetros del dispositivo para diversas bacterias para tolerar altos niveles de tensión de la membrana sin romperse. Nuevos desarrollos aseguraron el paso intacto de bacterias sin degradación y con viabilidad.
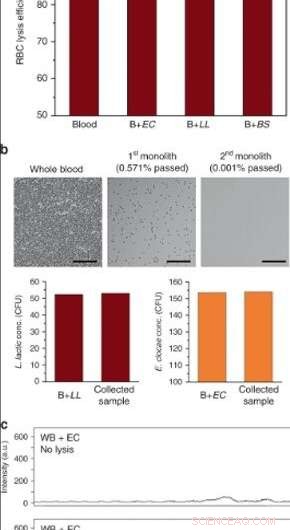
(a) Eficiencia de lisis de glóbulos rojos de sangre completa en dispositivos de alto rendimiento después de la perfusión a 10 μL / min (EC E. cloacae, LL L. lactis, BS B. subtilis. Las barras de error son ± SD. N =3 para sangre y B + EC, y N =2 para B + LL, B + BS. (b) Lisis de células sanguíneas y separación bacteriana después de una operación en serie utilizando dos monolitos. Las superficies se pasivaron con BSA / Tween 20. Se obtuvo una lisis de RBC superior al 99,999% mientras se conservaba la viabilidad de L. lactis y E. cloacae. Barras de escala =100 µm. c Espectros Raman de sangre completa enriquecida con E. cloacae (superior) antes y (debajo) después del procesamiento a través del monolito de sílice poroso. Crédito:Microsistemas y Nanoingeniería, doi:10.1038 / s41378-019-0063-4.
Para el paso bacteriano de alto rendimiento, los científicos diluyeron la sangre en los dispositivos capilares. Sin embargo, como alternativa, también podrían ampliar la capacidad de los monolitos para la lisis de sangre completa. Los dispositivos procesaron más de 400 µL de sangre completa enriquecida con bacterias antes de mostrar un aumento significativo de la contrapresión. debido a la obstrucción como resultado de la lisis celular y también debido a los leucocitos intactos (WBC) atrapados dentro de la matriz porosa.
Para localizar las bacterias objetivo, Han y col. obtuvo una muestra depositada sobre un portaobjetos de vidrio, después de pasar por el proceso monolítico. Llevaron a cabo un análisis Raman de celda única escaneando manualmente la sonda óptica a través de la muestra. Esperan el uso de tecnología de lisis selectiva, acoplado a la microscopía confocal Raman en el futuro para mejorar el proceso de detección de cepas bacterianas de interés a bajas concentraciones en una ubicación de interés definida.
De este modo, Jung Y. Han y sus colegas desarrollaron un monolito de microfluidos para aislar de manera eficiente las bacterias intactas con teranósticos de amplio alcance, Potencial de punto de atención para aplicaciones clínicas. Ellos prevén la unión de herramientas de microscopía confocal Raman que actualmente están confinadas en gran medida al laboratorio de investigación con sistemas portátiles y miniaturizados emergentes para allanar el camino hacia dispositivos rápidos y portátiles en el punto de atención.
© 2019 Science X Network