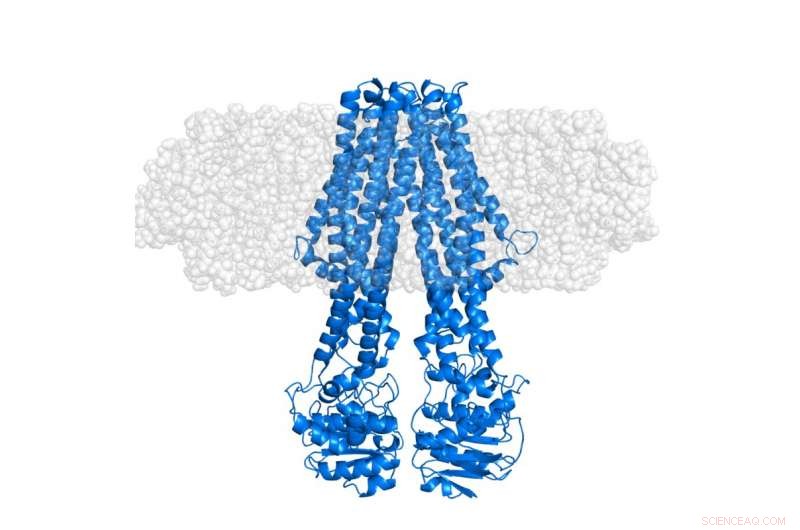
La proteína de membrana integral MsbA (azul) incrustada en un nanodisco membranoso "semitransparente" (gris). El nanodisco en sí mismo es, mediante deuteración selectiva, se volvió invisible en los experimentos de SANS que se centran en la conformación de la proteína en su contexto nativo. Crédito:Institut Laue-Langevin
Las membranas que rodean nuestras células contienen una gran cantidad de proteínas. Las proteínas de membrana son, por tanto, una clase crucial de macromoléculas en los sistemas vivos. Juegan papeles clave, como proporcionar pasarelas de transporte dentro y fuera de la celda, facilitar la señalización entre células, además de participar en la catálisis enzimática. Estos roles funcionales los hacen particularmente importantes como objetivos farmacológicos, con la mayoría de las terapias actuales dirigidas a proteínas de membrana.
Sin embargo, Los estudios estructurales de proteínas integrales de membrana (IMP) han resultado ser extremadamente desafiantes, ya que la mayoría de ellos son difíciles de estudiar adecuadamente en ausencia de su entorno lipídico. Esto a menudo evita que se cristalicen, un método comúnmente utilizado en biología estructural clásica. Por lo tanto, se requieren enfoques alternativos para estudios estructurales de IMP en entornos membranosos. Para este propósito, el Grupo de Ciencias de la Vida del Institut Laue-Langevin (ILL), en colaboración con la Universidad de Copenhague, ha sido pionero con éxito en el desarrollo de nanodiscos portadores furtivos. En este enfoque, Se utiliza un sofisticado método de etiquetado de deuterio para hacer que la membrana sea efectivamente invisible a la difracción de neutrones de baja resolución y, al mismo tiempo, resaltar la estructura de los IMP dentro de su entorno lipídico habitual. como se publicó en Acta Crystallographica D en 2014.
Más recientemente, El primer estudio estructural de una proteína de membrana integral que utiliza esta estrategia de deuteración de nanodiscos portadores furtivos acaba de completarse. Esto se llevó a cabo utilizando la plataforma Deuteration Laboratory (D-Lab) de Partnership for Structural Biology (PSB) junto con la dispersión de neutrones de ángulo pequeño (SANS) y la dispersión de rayos X (SAXS) proporcionada a través de la plataforma PSB SANS / SAXS. . Según lo publicado en la revista Estructura por Josts et al, el equipo internacional, dirigido por Henning Tidow, Universidad de Hamburgo, aplicó este método a una proteína transportadora de casete de unión a ATP (ABC), MsbA - que juega un papel importante en el transporte de lípidos en bacterias. Los datos de dispersión de neutrones resultantes, principalmente adquirido utilizando el instrumento D11 en ILL, permitió la observación directa de la señal de la proteína de membrana solubilizada sin contribución del lípido circundante. Los datos de SAXS proporcionaron una referencia clara para la forma externa del nanodisco, inclusive de la bicapa lipídica.
Además, Se estudiaron los cambios conformacionales en MsbA, demostrando la sensibilidad del método y su aplicabilidad general a los estudios estructurales de IMP.
Es probable que este enfoque se vuelva cada vez más importante en los estudios futuros de estos pero críticamente importante, macromoléculas biológicas, a su vez, apoyando una mejor comprensión del desarrollo de fármacos dirigidos a las proteínas de membrana.