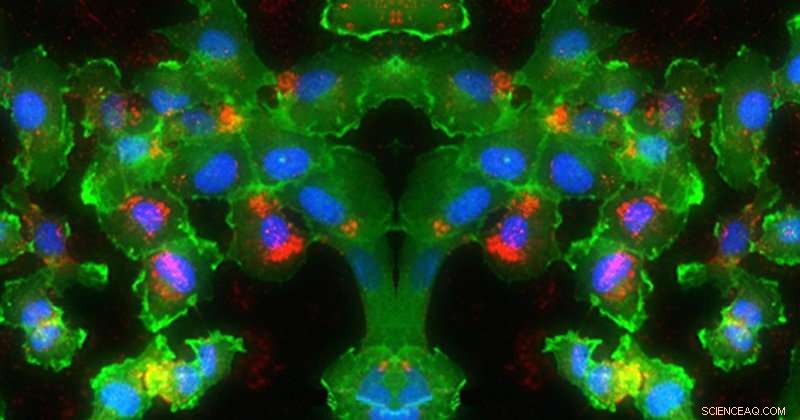
En esta imagen, El ARN (rojo) se administra a los núcleos (azul) de las células (verde). Crédito:Universidad de Delaware, Evan Krape, Emily Day y Joy Smoker
Los tratamientos contra el cáncer, desde la radiación hasta la cirugía y la quimioterapia, están diseñados para eliminar o destruir células cancerosas, pero las células sanas a menudo se convierten en daños colaterales en el proceso. ¿Qué pasaría si pudiera usar láseres para señalar el área de tratamiento y administrar medicamentos solo a las células cancerosas?
Un equipo de investigación de la Universidad de Delaware, dirigido por Emily Day, un profesor asistente de ingeniería biomédica, está sentando las bases de un método para inhibir los genes que promueven el cáncer en las células cancerosas y dejar intactas las células sanas. En un nuevo artículo publicado en Nano letras , el equipo revela conocimientos sin precedentes sobre este método prometedor, que implica recubrir nanopartículas con agentes reguladores de genes y luego exponerlas a una dosis de luz láser para liberar ese material.
Debido a que las nanopartículas mantienen inactivos a los agentes reguladores de genes hasta que su liberación se activa bajo demanda con luz, tienen un potencial sustancial para permitir una terapia contra el cáncer de alta precisión al tiempo que minimizan el impacto en las células sanas no irradiadas. Day y su equipo probaron su nuevo método contra células de tumores cerebrales utilizando nanopartículas para silenciar la expresión de la proteína verde fluorescente (GFP) en las células.
Una nueva forma de combinar láseres y nanopartículas
Como bisturís y suturas, Los láseres se utilizan a menudo en procedimientos médicos. Los oftalmólogos utilizan láseres para remodelar las córneas en la cirugía ocular para corregir la visión. Los dermatólogos usan láseres para atenuar las cicatrices de la piel. Los cardiólogos usan láseres para abrir las arterias obstruidas. Los oncólogos usan láseres para destruir células cancerosas y tumores.
El Day Lab tiene como objetivo combinar láseres con nanopartículas reguladoras de genes sensibles a la luz para aniquilar estratégicamente las células cancerosas y minimizar el daño colateral.
Comienzan con pequeños ARN interferentes, conocidos como ARNip, que son moléculas formadas por hebras complementarias de ARN que pueden reducir la expresión de ciertos genes en las células cancerosas. Los ARNip están recubiertos de nanopartículas de sílice y oro, que miden más pequeño que el ancho de un cabello humano. Estas partículas protegen los ARNip hasta que llegan al área de tratamiento deseada. La pregunta es:¿cómo los suelta exactamente en el lugar correcto?
"Previamente, si la gente quisiera administrar ARN con nanopartículas, podrían cubrir las nanopartículas con un polímero o péptido que penetra en las células, un agente para facilitar la captación y el suministro de células, Dijo Day. El problema es que esos agentes no son específicos. Terminas obteniendo regulación genética en todas las células, no solo las células cancerosas a las que pretendía apuntar para la regulación genética ".
Ahí es donde entra en juego la precisión de los láseres.
"La liberación de ARNip activada por la luz le permite silenciar genes solo donde las partículas y la luz se combinan, "Dijo Day." Ya que eliges dónde va la luz, y así donde se libera el ARNip, puede lograr un silenciamiento génico muy específico en células tumorales, reduciendo el potencial de efectos fuera del objetivo ".
Para estos experimentos, Day y su equipo (dirigido por la estudiante graduada del Departamento de Ingeniería Biomédica Rachel Riley) expusieron las nanopartículas recubiertas de ARNip a luz de onda continua o pulsos cortos de luz administrados cada una cuadrillonésima de segundo. Ambos tipos de irradiación desencadenaron la liberación de ARNip en formas monocatenarias y bicatenarias, lo que fue una sorpresa ya que estudios previos en la literatura científica sugirieron que la irradiación de onda continua liberaría solo hebras simples de ARNip (lo que significa que las dos cadenas complementarias del ARNip se separaron entre sí, en lugar de que todo el dúplex se libere de la superficie de la nanopartícula).
"Esta es la primera vez que alguien ha demostrado que se pueden liberar tanto dúplex de ARNip como hebras simples de ARN a partir de nanopartículas utilizando un láser de onda continua como fuente de excitación, "dijo Day". Sin embargo, Nuestros estudios también revelan que la luz pulsada es mucho más eficiente para liberar dúplex de ARNip que la luz de onda continua. Es imperativo que se liberen principalmente dúplex de las nanopartículas porque solo el ARNip dúplex funcionará dentro de las células para silenciar la expresión de los genes diana ".
El día continuó, "Más lejos, Nuestros estudios muestran que la luz pulsada no calienta las células como lo hace la luz de onda continua. Esto es importante ya que demasiado calor puede causar que las células se dañen por mecanismos distintos de la regulación genética deseada ".
Su grupo de laboratorio está bien equipado para descubrir tales conocimientos sobre el mecanismo de liberación de ARN activada por la luz a partir de nanopartículas porque realizan una investigación interdisciplinaria única.

Desde la izquierda, Margaret Billingsley, Emily Day, y Rachel Riley se muestran trabajando en uno de sus estudios de investigación anteriores, éste sobre detección de cáncer. Crédito:Universidad de Delaware, Evan Krape, Emily Day y Joy Smoker
"Mi laboratorio tiene mucha experiencia en administración de ARN y biología del cáncer, por lo que tenemos muchas más habilidades en biología molecular de las que podría tener un laboratorio de nanotecnología tradicional, y esto nos permite estudiar la función de los nanoportadores de ARN con un detalle sin precedentes, " ella dijo.
La nueva información que arroja la investigación de Day sobre el uso de la luz de onda continua frente a la luz pulsada para la liberación de ARNip desencadenada a partir de nanopartículas es una contribución importante al campo de la administración de fármacos. Además de demostrar las diferencias funcionales entre los dos modos de excitación de la luz, El equipo también demostró que el ARNip liberado de las nanopartículas tras la exposición a la luz pulsada redujo la expresión del gen objetivo (proteína verde fluorescente) mejor que un material disponible comercialmente que se utiliza a menudo para administrar ARNip en las células en experimentos de laboratorio. Esta fue una observación emocionante que demostró el impacto potencial de este nuevo sistema.
Este trabajo se realizó en colaboración con Lars Gundlach en el Departamento de Química y Bioquímica y el Departamento de Física y Astronomía de la UD, que posee el láser pulsado utilizado en estos experimentos. Se necesita mucha más investigación antes de que esto pueda traducirse en un tratamiento viable para los pacientes con cáncer.
¿Que sigue?
"El siguiente paso sería demostrar que podemos hacer esto con una carga de ARN más funcional y biológicamente relevante que el ARNip dirigido a la proteína verde fluorescente que se usó en este trabajo, "Dijo Day." Hay muchos genes diferentes que se sabe que controlan el crecimiento del cáncer, so we will deliver RNA that targets genes that we know to be important in tumor progression and see if we are delivering enough to have an impact."
The team is particularly interested in studying the delivery of siRNA targeting beta-catenin, which plays an important role in triple-negative breast cancer, and also the delivery of microRNA (which is similar to siRNA, but can regulate multiple genes simultaneously). Por ejemplo, Day's team hopes to deliver miR-34a, which is considered a master regulator of gene expression in cancer.
In addition to Day and Gundlach, the paper's authors include Rachel Riley, a doctoral student in the Department of Biomedical Engineering; Megan Dang, a doctoral student in Department of Biomedical Engineering; Maggie Billingsley, a senior undergraduate student in the Department of Biomedical Engineering; Baxter Abraham, a doctoral student in the Department of Chemistry and Biochemistry.
Riley, who will soon begin work as a postdoctoral associate at the University of Pennsylvania, started graduate school at UD because she wanted to do science that could make a real impact on the medical field. After losing an aunt to cancer, she was especially motivated to put her talents toward research that could someday help patients.
"The Day Lab's idea of incorporating nanoparticles for specific delivery of therapeutic agents was a really unique approach, " ella dijo.
Billingsley has done research in the Day Lab since her first year at UD and wrote three peer-reviewed papers based on her work in the group. In 2017, she was the first author on a paper published in Más uno . Próximo, Billingsley will attend graduate school at the University of Pennsylvania, where she will study immunotherapy. (She and Riley, a duo Day calls a "dream team, " could likely work together in the future.)
"When interviewing with graduate schools, this experience with The Day Lab was the main thing that helped me stand out in interviews and also understand what I wanted out of graduate school, " Billingsley said. "I have had so many opportunities to go down my own path and also work with others on new methods, ideas and areas of research."
This paper also gave Billingsley a taste of an important aspect of scientific discovery.
"We found some results that conflicted with literature, which was a new experience for me, " she said. "That was more exciting that just confirming what was expected."
En general, Day and her team are excited to further pursue this technology to reveal its potential as a high precision cancer therapy.