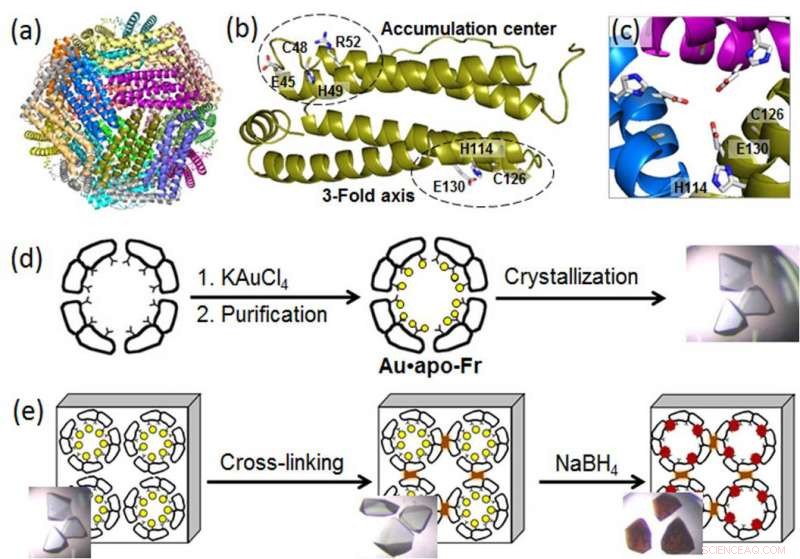
(a) Estructura de la molécula de ferritina de 24 meros; (b) un monómero de ferritina con los sitios de unión al metal; (c) un canal simétrico de 3 ejes; (d) preparación y cristalización de ferritina que contiene Au; (e) reticulación del cristal de ferritina y reducción de iones de Au (círculos amarillos) en átomos de Au (0) que forman nanoclusters (partículas marrones). Crédito:Instituto de Tecnología de Tokio
Los científicos del Instituto de Tecnología de Tokio han utilizado cristalografía de alta resolución para descubrir el mecanismo detrás de la síntesis asistida por proteínas de nanopartículas de oro. proporcionando una plataforma para diseñar nanomateriales adaptados para aplicaciones biomédicas.
En organismos vivos, Los iones metálicos libres se almacenan y transportan a través de proteínas ensambladas en estructuras altamente ordenadas, como las jaulas de proteínas, a través de una reacción llamada biomineralización. Esta sofisticada estrategia biológica ha atraído la atención de los biotecnólogos que especulan que las jaulas de proteínas de almacenamiento de iones naturales pueden usarse para cultivar nanopartículas metálicas con las propiedades deseadas.
Las nanopartículas de oro (AuNP) son conocidas por sus excelentes funciones en catálisis, bioimagen, entrega de medicamentos, y terapia; por lo tanto, La síntesis de AuPs con tamaños y formas controladas es muy importante para su aplicación en nanomedicina. En andamios de proteínas, Las AuNP se forman mediante un proceso secuencial que implica la deposición y aglomeración de oro en pequeños nanoclusters que actúan como centros de nucleación para el crecimiento de AuNP. Sin embargo, el mecanismo dinámico que subyace a la formación de nanoclusters de oro en entornos proteicos sigue sin estar claro.
Para revelar los procesos moleculares detrás del crecimiento de AuNP en nanocajas de proteínas, un grupo de ingenieros biomoleculares del Instituto de Tecnología de Tokio, dirigido por Takafumi Ueno, utilizaron cristalografía de alta resolución y analizaron la formación de nanoclusters de oro en ferritina. Una proteína de almacenamiento de hierro intracelular universal producida por casi todos los organismos vivos, la ferritina forma una nanocaja autoensamblada de 24 subunidades con dos sitios específicos de unión a metales:el canal de 3 ejes y el centro de acumulación (Figura). Dado que los iones de oro tienen una gran afinidad por el azufre, los científicos modificaron el centro de acumulación introduciendo un residuo adicional de cisteína que contenía azufre para mejorar la absorción de oro en la jaula de proteínas. Luego, reforzaron los cristales de ferritina que contienen Au mediante reticulación en glutaraldehído (Figura) para mantener su estructura reticular. Estas modificaciones permitieron la reducción de iones de oro en los cristales y la determinación de las posiciones de unión de los iones de oro dentro de la caja de ferritina mediante cristalografía de alta resolución.
En el siguiente paso, los iones de oro inmovilizados se redujeron a átomos de Au (0) usando un agente reductor (NaBH4). Como resultado, los científicos pudieron observar que el oro reducido se aglomeraba en nanoagrupamientos formados en los canales simétricos triples y en los centros de acumulación de metal, lo cual se debió al movimiento gradual del oro y los cambios conformacionales de los aminoácidos circundantes.
Los resultados obtenidos por el profesor Ueno y sus colegas descubren el mecanismo detrás de la formación de nanoclusters de oro que se esperan como centros de nucleación para el crecimiento posterior de AuNP en el entorno proteico único. proporcionando una plataforma para la investigación futura de la biomineralización y la síntesis de nanopartículas en andamios biomoleculares.