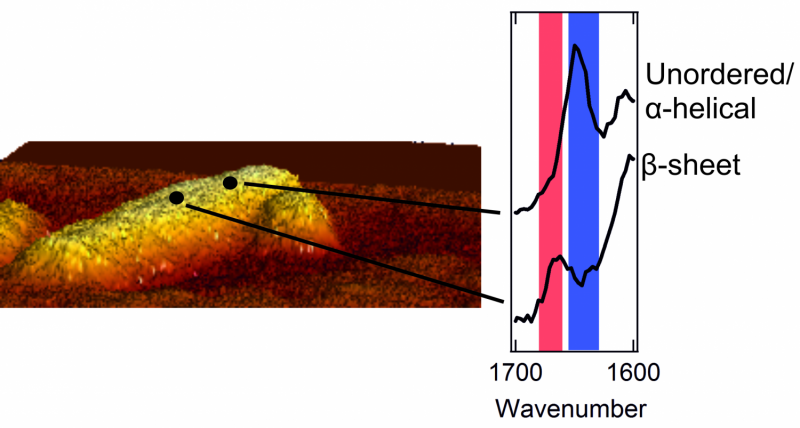
Izquierda:una imagen de microscopio de fuerza atómica de una fibrilla con un diámetro de unos pocos nanómetros. Derecha:dos espectros que muestran la estructura exterior. Un pico en el área roja es característico de un parche con una estructura de hoja beta cuidadosamente ordenada. Un pico en el área azul es típico de un área con un caótico, estructura desordenada.
Los investigadores del Instituto FOM AMOLF tienen, por primera vez, logró hacer una imagen de la estructura exterior de un agregado proteico que causa enfermedades como el Alzheimer y la diabetes tipo 2. Descubrieron que la superficie exterior de estos agregados está estructurada de una manera muy desordenada, a diferencia de sus interiores prolijamente dispuestos. Los investigadores esperan que su trabajo proporcione más información sobre la forma en que los agregados dañan las células cercanas. Los hallazgos de la investigación se publicaron en línea en la revista. Pequeña el 7 de mayo, 2015.
Los agregados de proteínas estudiados por los investigadores consisten en largos, proteínas plegadas. Los investigadores han estado familiarizados con la estructura interior de estos agregados (conocidos formalmente como fibrillas amiloides) durante bastante tiempo. Sin embargo, con los microscopios convencionales siempre resultaba imposible ver las estructuras proteicas en la superficie exterior de los agregados. En retrospectiva, era como si los investigadores estuvieran encerrados dentro de una casa. Podrían estudiar a fondo el interior de la casa, pero mientras no tuvieran la llave, no pudieron salir y mirar su fachada por fuera. El gran avance se produjo cuando los investigadores idearon esa "clave" mediante la combinación de dos técnicas diferentes:microscopía y espectroscopía. Esto les permitió finalmente estudiar el "ladrillo" exterior.
Desordenado
Una vez que pudieron vislumbrar el exterior de los agregados de proteínas, los investigadores se llevaron una sorpresa. El interior de los agregados está estrictamente organizado. Las proteínas están ordenadas en una estructura de hoja beta llamada, que forma un retorcido, hoja plegada. Sin embargo, encontraron que el exterior del agregado tiene una estructura mucho más desordenada y caótica. Es decir, las proteínas exteriores forman un desorganizado, patrón irregular. Aquí y allá, hay parches que forman una estructura de hoja beta, pero en otros lugares esta regularidad no se encuentra en ninguna parte. Los investigadores incluso encontraron diferencias estructurales de un nanómetro a otro, en una y la misma fibrilla.
Los investigadores también notaron que la estructura exterior de cada fibrilla es muy diferente de la siguiente. Una fibrilla puede contener muchos parches con una estructura de hoja beta, mientras que otro carece de estos parches regulares casi por completo. Es más, los aminoácidos que se pueden encontrar en el exterior también difieren para cada fibrilla.
El exterior desordenado está en contacto directo con las membranas de las células vecinas. De este modo, su estructura juega un papel crucial en el daño de estas células. Este tipo de daño celular se encuentra comúnmente en pacientes con diabetes tipo 2 o enfermedad de Alzheimer.
La 'llave' que abrió las puertas
Los investigadores de AMOLF colaboraron con sus colegas de la Universidad de Utrecht, el Instituto Max Planck de Investigación de Polímeros en Mainz, y el Instituto Leibniz de Tecnología Fotónica en Jena para desarrollar una nueva forma de ver la estructura proteica exterior de los agregados. La clave resultó ser una combinación de espectroscopía y microscopía de fuerza atómica.
Un microscopio de fuerza atómica consiste en una punta afilada (sonda) que se mueve sobre la superficie de un objeto. Esto permite que el microscopio explore una fibrilla de amiloide a escala atómica y haga un mapa en relieve. Mientras tanto, el espectrómetro mide el llamado espectro Raman para cada píxel del mapa. Estos espectros dan información sobre la forma en que se pliegan las proteínas, y la presencia de aminoácidos específicos en la superficie de los agregados. Las señales medidas por el espectrómetro suelen ser débiles, pero una capa metálica en la punta del microscopio los amplifica enormemente.
Las imágenes del exterior de las fibrillas amiloides se habían hecho antes, pero el equipo ahora también tomó imágenes de la forma en que se plegaron las proteínas. Primera autora, Corianne van den Akker:"Combinando microscopía y espectroscopía, Logramos vincular cada fragmento de estructura a una ubicación en el exterior del amiloide. De este modo, podríamos hacer una imagen con resolución a nanoescala, así como determinar la estructura en cada ubicación. Esa es la hazaña única de la técnica que usamos ".
El siguiente paso
Con el conocimiento recién adquirido, También será posible medir la estructura de los amiloides que se han formado en el exterior de las células vivas. La técnica también se puede utilizar para probar medicamentos que tienen como objetivo prevenir o disolver los agregados de proteínas.