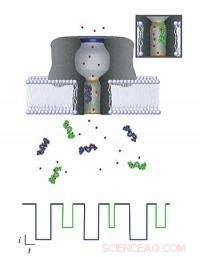
Cada molécula que pasa a través del nanoporo se puede identificar monitoreando el cambio que causa en una corriente iónica que fluye a través de la membrana. Cuando diferentes moléculas (objetos de color púrpura y verde) ingresan al poro (se muestra el verde en el recuadro), cada uno reduce la corriente en una cierta cantidad y período de tiempo (mostrado por el esquema de color correspondiente en el diagrama actual a continuación), dependiendo tanto de su tamaño como de su capacidad para atraer iones cercanos (puntos rojos). El modelo NIST se puede utilizar para extraer esta información, que podría usarse para identificar y caracterizar biomarcadores para aplicaciones médicas. Crédito:NIST
Los científicos del Instituto Nacional de Estándares y Tecnología se han acercado un paso más al desarrollo de los medios para un análisis de sangre de diagnóstico rápido que puede escanear miles de marcadores de enfermedades y otros indicadores químicos de la salud. El equipo informa que ha aprendido a decodificar las señales eléctricas generadas por un nanoporo, una "puerta" de menos de 2 nanómetros de ancho en una membrana celular artificial.
Los nanoporos no son nuevos en sí mismos; durante más de una década, Los científicos han intentado utilizar un detector eléctrico basado en nanoporos para caracterizar el ADN monocatenario para aplicaciones de secuenciación genética. Más recientemente, Los científicos del NIST centraron su atención en el uso de nanoporos para identificar, cuantificar y caracterizar cada uno de los más de 20, 000 proteínas que produce el cuerpo, una capacidad que proporcionaría una instantánea de la salud general de un paciente en un momento dado. Pero mientras que los nanoporos permiten que las moléculas entren en ellos de una en una, determinar qué molécula individual específica acaba de pasar no ha sido fácil.
Para abordar este problema, Los miembros del equipo del NIST que previamente desarrollaron un método para distinguir tanto el tamaño como la concentración de cada tipo de molécula que admite el nanoporo, ahora han respondido a la pregunta de cómo estas moléculas individuales interactúan con el nanoporo. Su nuevo modelo teórico describe la física y la química de cómo el nanoporo, en efecto, analiza una molécula, un entendimiento que hará avanzar el uso de nanoporos en el campo médico.
"Este trabajo nos acerca un paso más a la realización de estos nanoporos como una poderosa herramienta de diagnóstico para la ciencia médica, "dice Joseph Reiner, quien realizó el trabajo con Joseph Robertson, y John Kasianowicz, toda la División de Electrónica de Semiconductores del NIST. "Se suma a la 'Piedra Rosetta' que nos permitirá leer qué moléculas acaban de pasar a través de un nanoporo".
Usando sus nuevos métodos, el equipo pudo modelar la interacción de un tipo particular de molécula grande a través de la apertura de un nanoporo con gran precisión. Las moléculas eran polietilenglicol (PEG), un polímero bien conocido que forma cadenas de longitud variable.
"Las cadenas de PEG pueden ser muy largas, pero cada enlace es muy pequeño, "Dice Kasianowicz." Fue una buena prueba porque queríamos ver si el nanoporo podía diferenciar entre dos moléculas grandes casi idénticas que difieren en longitud en sólo unos pocos átomos ".
El dispositivo del equipo pudo distinguir fácilmente entre cadenas de PEG de diferentes tamaños, y el modelo que han desarrollado para describir las interacciones PEG-nanoporo les está animando a pensar que con más esfuerzo, los minúsculos sensores se pueden personalizar para medir rápidamente muchas moléculas diferentes. "Posiblemente podríamos construir una serie de muchos nanoporos, cada uno creado para medir una sustancia específica, ", Dice Kasianowicz." Debido a que cada nanoporo es tan pequeño, una matriz con una por cada proteína del cuerpo aún sería pequeña ".