Ya sea en forma de escarcha o de un cubito de hielo liso y transparente, el hielo se adhiere espontáneamente e incluso con bastante fuerza a muchas superficies sólidas. Sin embargo, como puede atestiguar cualquier persona descuidada que haya patinado en una acera invernal, el hielo también puede ser muy resbaladizo. De hecho, el hielo puede ser pegajoso y resbaladizo.
Esta versatilidad ha desconcertado a los científicos durante mucho tiempo. Para empezar, llevan más de 150 años intentando descifrar el secreto de lo resbaladizo del hielo. Entre ellos se encuentran físicos famosos como Lord Kelvin y Michael Faraday. Este último, más conocido por sus trabajos en electromagnetismo, fue el primero en prever la presencia de una fina capa de agua líquida que recubría el hielo, incluso muy por debajo de los 0°C. En ese momento, razonó que el contacto de un objeto sólido contra la capa superficial lo impulsaba a actuar como lubricante, reduciendo en gran medida la fricción sobre el hielo. La existencia de esta capa líquida fue confirmada mediante experimentos más de un siglo después.
Para responder a la pregunta "¿Por qué el hielo es resbaladizo?" Primero debemos entender cómo se formó esta fina capa de agua líquida sobre la superficie congelada.
Como el agua es más densa en su fase líquida que en su estado helado, durante mucho tiempo se pensó que el derretimiento de la superficie del hielo estaba relacionado con un exceso de presión, por ejemplo, debido al peso del patinador sobre la pequeña superficie que se encontraba debajo de ella o sus patines. Al comprimir aún más el hielo, el patinador haría que se derritiera, volviéndolo líquido y resbaladizo.
Otros creen que el calor se libera por fricción cuando el objeto se mueve sobre el hielo, lo que hace que la superficie se derrita. Al igual que cuando te frotas las manos para calentarlas, cuando frotas un sólido contra otro, se calientan.
Sin embargo, estos dos mecanismos no explican por qué el hielo sigue siendo resbaladizo por debajo de -20°C. A tales temperaturas, se necesitaría una presión considerable (alrededor de 500 veces la ejercida por un patín de hielo) para hacer que se derrita.
En la década de 1960, más de un siglo después de Faraday, J.W. Telford y J.S. Turner pasó lentamente un cable a través del hielo "frío" (por debajo de -20 °C) para revelar que seguía siendo resbaladizo hasta -35 °C, momento en el que el calor liberado por la fricción ya no era suficiente para derretir el hielo.
Sólo un siglo después de la intuición de Faraday pudimos demostrar indirectamente esta capa líquida, midiendo las propiedades de la superficie del hielo y no el volumen; en este caso sus propiedades de absorción de vapores de hidrocarburos, que son bastante comparables a las de ¡Agua líquida!
Las técnicas de dispersión de protones o de rayos X, utilizadas habitualmente para estudiar la estructura de los cristales, han permitido estimar el espesor entre uno y varios centenares de nanómetros. Algunos estudios incluso han sugerido que este espesor diverge cuando la temperatura se acerca a los 0°C.
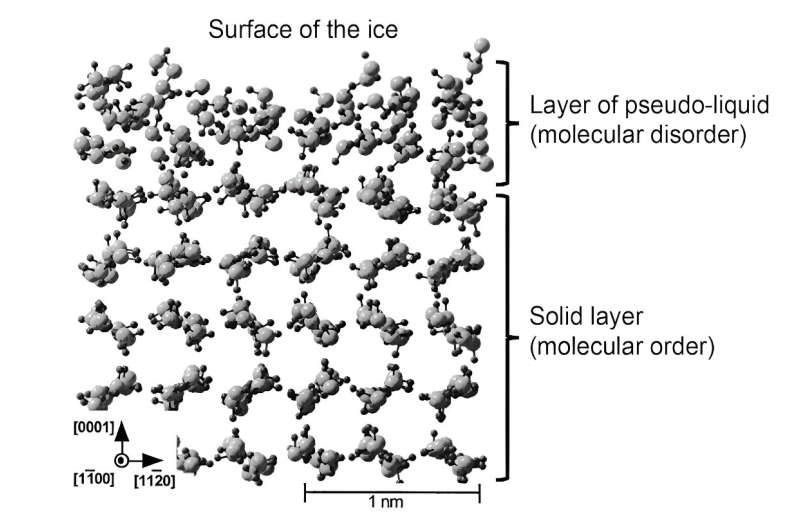
Más recientemente, las simulaciones han permitido representar mejor la estructura de esta capa líquida. Posteriormente, esta capa se denominó "pseudolíquida" o "cuasilíquida" para diferenciarla de la verdadera fase líquida. Estos trabajos teóricos han demostrado que en esta capa superficial las moléculas pueden moverse más libremente, lo que confirma su papel como lubricante. Sin embargo, la estructura molecular no es exactamente la misma que la del agua líquida, lo que tiene consecuencias en las propiedades mecánicas de esta capa pseudolíquida.
Un estudio reciente mostró una fuerte correlación entre la movilidad individual de las moléculas y el coeficiente de fricción macroscópico (cuanto menor es el coeficiente, más fácil es deslizarse), lo que sugiere que no es tanto el espesor de la capa lo que importa para el deslizamiento. sino más bien el movimiento individual de las moléculas. El valor mínimo del coeficiente de fricción se mide a -7°C, conocida como la temperatura óptima para esquiadores y patinadores.
Otra investigación se dirigió al corazón de la capa pseudolíquida utilizando una nanosonda, la punta de un microscopio de fuerza atómica. Al hacer vibrar esta punta conectada a un sensor de fuerza extremadamente preciso, midiendo la fricción entre la punta y el líquido de la capa, los autores midieron que este líquido puede ser 50 veces más viscoso que el agua líquida y que también posee elasticidad (una propiedad más asociado al estado sólido). Esta viscosidad es similar a la de los aceites comestibles, lo que hace que la capa pseudolíquida sea un excelente lubricante.
En resumen:el hielo se desliza porque en su superficie se forma una capa líquida de aproximadamente 1 a 100 nanómetros de espesor. Sus propiedades mecánicas (viscosidad, elasticidad), diferentes a las del agua líquida, y la movilidad de las moléculas que la componen, muy superior a la del hielo sólido, le confieren sus excepcionales propiedades lubricantes.
La pegajosidad del hielo, sin embargo, sigue desconcertando a los científicos, a pesar de 70 años de experimentos. En este último caso, los científicos han tendido a utilizar un kit bastante simple:un pistón conectado a un sensor de fuerza empuja un bloque de hielo, que a su vez está pegado a un objeto sólido. Cuando el cubo de hielo se desprende, la fuerza registrada por el sensor de repente se vuelve cero y se mide el valor máximo antes de esta ruptura. Pero estos resultados han mostrado tendencias a veces contradictorias y una dispersión bastante amplia.
Una revisión reciente sobre el tema concluyó que la fuerza de adhesión del hielo "depende no sólo de la composición química, la rugosidad de la superficie, las propiedades mecánicas y térmicas del sustrato [sino] que también depende críticamente de la temperatura e incluso del dispositivo experimental para medir la adhesión". ."
Para ser un poco más precisos, cuando exploramos la literatura sobre el tema durante los últimos 60 años, observamos que la fuerza con la que el hielo se adhiere a un sólido depende fuertemente de la temperatura en un rango entre -20°C y 0°C ( el hielo se pega más fuerte a un sólido más frío). En cuanto al papel de la rugosidad de la superficie, es ambivalente:para algunos sólidos (particularmente metales), el hielo se adhiere más fuertemente a un sustrato más rugoso, mientras que en algunos plásticos ocurre al revés...
Finalmente, a nivel químico, el agua líquida puede distribuirse mejor en algunas superficies que en otras. Por ejemplo, el agua se esparce muy bien sobre el vidrio limpio, mientras que algunas superficies son hidrofóbicas, como el teflón.
Un estudio reciente ha demostrado que cuanto más agua en estado líquido se esparza sobre la superficie de un sólido, más hielo se adherirá a este sólido. Por el contrario, una superficie con poca afinidad por el agua líquida también tendrá poca adherencia al hielo.
¿Por qué esta relación entre la propagación del agua y la adhesión del hielo? Primero, para que el hielo se adhiera a un sólido frío, el agua en estado líquido debe haber podido congelarse al entrar en contacto con el sólido. Aquí hay un experimento simple que cualquiera puede hacer:
¿Qué podemos concluir? Intuitivamente, cuanto mayor es la afinidad del agua por la superficie, más fácilmente el agua líquida se filtra en las rugosidades y huecos de la superficie del sólido, aumentando la superficie de contacto entre éste y el hielo después de la solidificación, consolidando así la adhesión. Este experimento también demuestra el papel del agua líquida como adhesivo. Cuando se utiliza un adhesivo convencional (por ejemplo, pegamento líquido) para unir dos partes, es cuando las partes se solidifican (por la evaporación de un solvente en el pegamento) que se produce la adhesión fuerte y definitiva. Lo mismo ocurre cuando el agua líquida se enfría al contacto con un sólido frío y se solidifica. La capa de agua congelada desempeña entonces el papel de uno de los sólidos.
No podemos explicar la adhesión del hielo en detalle, pero podemos intentar reducir su fuerza. Naturalmente ha surgido la idea de utilizar tratamientos hidrófugos, pero estos tratamientos no son muy duraderos en el tiempo y pueden tener el efecto contrario al previsto. Las soluciones más prometedoras implican esparcir una fina capa de aceite o un hidrogel sobre la superficie, pero todavía existen problemas con la estabilidad de estas capas en grandes áreas.
Otro enfoque es utilizar métodos activos de deshielo. Una de esas técnicas es el ultrasonido superficial, que genera "microterremotos" en la superficie sólida y puede provocar que el hielo se desprenda. Actualmente estamos estudiando este método en el laboratorio del MSC.
Proporcionado por The Conversation
Este artículo se vuelve a publicar desde The Conversation bajo una licencia Creative Commons. Lea el artículo original. 