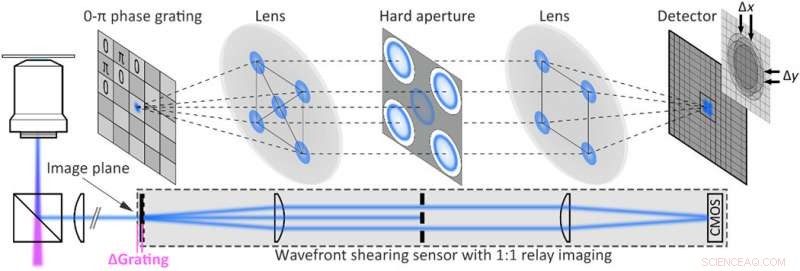
Implementación experimental de holografía de fluorescencia de disparo único. Configuración de holografía de cizallamiento de fluorescencia obtenida al extender un microscopio de campo amplio de fluorescencia con un sensor de frente de onda compuesto por una rejilla de fase 2D 0-π y un sistema de imágenes de relé montado en el puerto de salida del microscopio. La apertura dura bloquea todos menos los primeros órdenes de difracción. Crédito:Science Advances, doi:10.1126 / sciadv.abc2508
Los biólogos suelen utilizar la microscopía de fluorescencia debido a la especificidad molecular y la superresolución de la técnica. Sin embargo, el método está retenido por los límites de imágenes. En un nuevo informe sobre Avances de la ciencia , Matz Liebel y un equipo de investigación del Instituto de Ciencia y Tecnología de Barcelona y el Hospital General de Massachusetts en España y EE. UU. Informaron sobre un enfoque de imágenes para recuperar el campo eléctrico completo de la luz fluorescente utilizando la sensibilidad de una sola molécula. El equipo experimentó con el concepto de holografía digital para la detección rápida de fluorescencia mediante el seguimiento de la trayectoria tridimensional (3-D) de nanopartículas individuales utilizando una resolución en el plano de 15 nanómetros. Como aplicaciones biológicas de prueba de concepto, los investigadores obtuvieron imágenes del movimiento tridimensional de las vesículas extracelulares dentro de las células vivas.
Nano entrega en tejido vivo
En este trabajo, Liebel y col. desarrollaron la localización de partículas en 3-D basada en holografía de fluorescencia a través de vesículas extracelulares dentro de células vivas y observaron vesículas fuertemente confinadas con períodos de transporte activo. La entrega del transporte de carga in vivo es actualmente un desafío importante, con el fin de implementar activamente plataformas de nanomedicina mínimamente invasivas. Las nanopartículas (NP) y los vehículos extracelulares pueden diseñarse como candidatos prometedores para ser utilizados como vehículos, pero los científicos aún no comprenden el recorrido preciso de tales dispositivos en los tejidos vivos.
Para superar estos desafíos, deben desarrollar métodos de obtención de imágenes de partículas individuales tridimensionales (3-D) de campo amplio para rastrear partículas individuales simultáneamente mientras viajan a su destino previsto. Los equipos de investigación habían implementado previamente enfoques holográficos a la microscopía, aunque la incoherencia de la luz fluorescente no es adecuada para células vivas o imágenes de una sola molécula. En comparación, La interferometría de cizallamiento es un método prometedor para lograr el registro de un solo disparo de procesos dinámicos. La idea subyacente detrás de la interferometría de corte incluye la autointerferencia para acceder a gradientes de fase hasta un nivel de fotón único para lograr una holografía de fluorescencia de un solo disparo. Los mecanismos desarrollados en este trabajo, por lo tanto, sirven para observar la translocación intracelular a través de escalas de longitud micrométrica para proporcionar a los biólogos una visión más profunda de los mecanismos intracelulares.

Flujo de trabajo de reconstrucción de campo eléctrico. (A) Imagen obtenida experimentalmente de perlas fluorescentes de 200 nm desenfocadas que muestran la modulación espacial inducida por cizallamiento de las funciones de dispersión puntual (PSF). (B) La transformación rápida de Fourier (FFT) de (A) permite el aislamiento de los términos de interferencia de interés tanto en la dimensión x como en la y mediante aislamiento de apertura dura y cambio a frecuencia cero. (C) La transformación rápida inversa de Fourier (iFFT) de los términos aislados de (B) produce los gradientes de fase deseados. (D) La integración 2D analítica con un solucionador de Poisson produce la imagen de fase sin procesar. (E) Escalado de fase, para tener en cuenta la distancia entre la rejilla y el chip de la cámara, seguido de la corrección de la aberración da como resultado las imágenes de fase final y amplitud. Todas las barras de escala son idénticas, y la envoltura de fase 0-2π es solo para fines de visualización; la información sin envolver se obtiene directamente. Crédito:Science Advances, doi:10.1126 / sciadv.abc2508
Principio de generación de imágenes y validación del sistema para el seguimiento de partículas en 3D
El equipo utilizó un microscopio de fluorescencia de campo amplio con un sensor de corte de frente de onda compuesto por un sistema de imágenes por relé. La geometría de la configuración aseguró que se midieran gradientes de fase distintos de cero y permitió que Liebel et al. para realizar una autointerferencia de fotón único en toda una imagen. El equipo tomó imágenes de perlas de poliestireno fluorescente como partículas de 200 nm fuera de foco y extrajo la información de intensidad como módulo de argumento de las imágenes filtradas para la extracción del gradiente de fase. Después de observar el campo eléctrico completo, utilizaron la óptica de Fourier para corregir aberraciones complejas inducidas por la dispersión o construir imágenes en cualquier plano de su elección. El equipo se centró en experimentos de localización 3-D que requerían la recuperación de la posición precisa de un emisor de interés en todas las dimensiones. incluido el plano Z. Los esfuerzos de enfoque computacional indicaron la capacidad precisa para determinar la posición tridimensional de múltiples partículas fluorescentes que se difunden libremente.
Prueba de la trayectoria de enfoque computacional
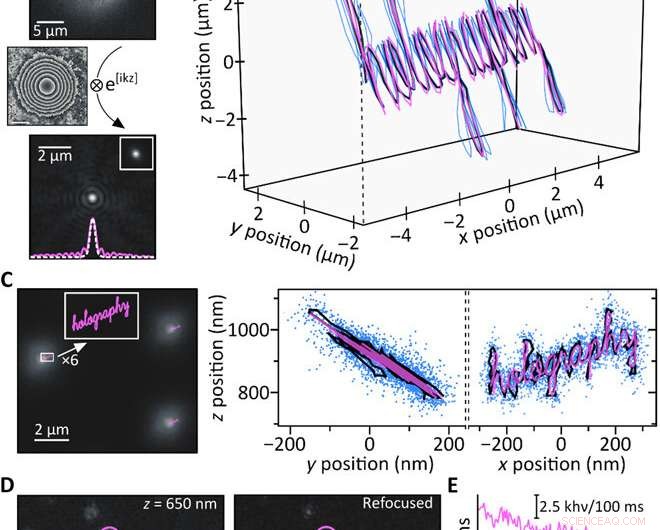
Experimentos de prueba de concepto. (A) Una cuenta fluorescente de 200 nm registrada 4,4 μm por encima del foco (arriba) se reenfoca computacionalmente (abajo). El recuadro muestra una imagen enfocada obtenida experimentalmente de la misma partícula junto con un corte a través de las respectivas PSF (rayas blancas:enfocadas; rosa, sólido:reenfocado). (B) Seguimiento 3D simultáneo de tres perlas fluorescentes de 200 nm moviendo la muestra con una etapa piezoeléctrica a lo largo de una trayectoria conocida (rosa:movimiento piezoeléctrico; azul:trayectorias reconstruidas de perlas individuales; negro:trayectoria media). Las trayectorias individuales se superponen en x / y para mayor claridad; z =0 μm corresponde a una partícula enfocada. (C) Piezotrayectorias limitadas por subdifracción prevista (rosa) en comparación con una imagen típica obtenida a 900 nm por encima del foco (izquierda). Las proyecciones de trayectoria media y / zyx / z resultantes (negro) concuerdan bien con la trayectoria piezoeléctrica (rosa), y los puntos azules muestran todas las posiciones obtenidas rastreando simultáneamente 17 perlas fluorescentes individuales (derecha). El análisis basado en histogramas de las precisiones de localización produce σx / σy =15 nm y σz =21,5 nm, respectivamente (nota S7). (D) Las moléculas individuales de ATTO647N registradas fuera de foco (izquierda) se enfocan con éxito de forma computacional (centro). Las áreas representativas de emisión de fluorescencia (rosa, púrpura, y azul) muestran el fotoblanqueo en un solo paso como se esperaba para emisores individuales. (E) Trazos de tiempo de fotoblanqueo de las tres regiones resaltadas en (D); la línea discontinua indica el nivel de fondo. Crédito:Science Advances, doi:10.1126 / sciadv.abc2508
Para probar el razonamiento computacional detrás de la configuración, Liebel y col. generó una trayectoria tridimensional conocida y movió una muestra que contenía perlas fluorescentes inmovilizadas, mientras grababa imágenes a lo largo del camino. Recuperaron la información de fase y amplitud y determinaron las posiciones tridimensionales de partículas individuales mediante propagación numérica. Para cuantificar el rango Z accesible, desenfocaron experimentalmente partículas individuales y luego volvieron a enfocar computacionalmente las imágenes para obtener mediciones sin artefactos en un rango Z de aproximadamente ocho µm. Es importante asegurar una localización precisa a nanoescala a través de escalas de longitud micrométrica en 3-D para captar imágenes que difunden partículas a nanoescala. La holografía de fluorescencia cumplía estos requisitos. Como prueba de concepto, los científicos imaginaron la palabra "holografía, "donde cada letra de entrada individual mide menos de 50 nm de ancho para obtener una salida bien resuelta, confirmando la capacidad de superresolución de la holografía fluorescente.
Imágenes de una sola molécula y captación celular de nanopartículas
El equipo mostró cómo funcionaba la holografía de fluorescencia en condiciones de superresolución biológicamente importantes midiendo una muestra compuesta de moléculas individuales. A pesar de intensidades de fluorescencia marcadamente reducidas en la configuración experimental, el equipo obtuvo un enfoque computacional hasta el límite de difracción incluso para niveles de fotones tan bajos como 10 4 fotones. Visualizaron el tráfico intracelular de nanopartículas inorgánicas y vesículas extracelulares utilizando el sistema. Como sistema modelo, utilizaron nanobarras de oro marcadas con fluorescencia que son inertes y, por lo tanto, no interfieren con las funciones celulares para acumularse en el citoplasma, como se verificó mediante imágenes de campo oscuro de células vivas. El equipo siguió las trayectorias de las partículas grabando imágenes de fluorescencia de lapso de tiempo y extrajo los términos de fase y amplitud. Las funciones de dispersión de puntos (PSF) ampliamente variables indicaron la presencia de nanobarras en diferentes posiciones Z en relación con el plano focal.

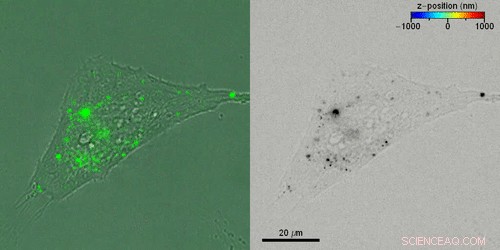
Seguimiento de fluorescencia 3D en células vivas. (A) Experimento típico de seguimiento de una sola partícula de células vivas. (B) Imágenes de fluorescencia saturada (rosa) superpuestas sobre las imágenes de campo brillante correspondientes de células de riñón de mono. (C) Amplitud de fluorescencia (izquierda) y fase (derecha) obtenidas mediante la obtención de imágenes de la muestra de celda B. Todas las películas se graban con un tiempo de exposición de 100 ms en un total de 100 fotogramas en un ciclo de trabajo de imágenes de 1/20 para permitir un largo plazo imágenes. Para tener en cuenta las grandes diferencias de brillo entre las partículas enfocadas y desenfocadas, mostramos la amplitud normalizada en lugar de la intensidad de la fluorescencia y limitamos la escala a 0,5 con el máximo en 1. Recuadros:original, desenvuelto imágenes de fase que resaltan la curvatura convexa / cóncava de las partículas por encima / por debajo del plano focal de la imagen. (D) Comparaciones de segmentos de imagen de amplitud originales obtenidos de (C) con imágenes obtenidas por propagación computacional de -2 μm (arriba) y 2 μm (abajo). (E) Trayectorias 3D obtenidas por holografía de fluorescencia para partículas que se difunden dentro de células vivas. Cada trayectoria individual tiene una barra de escala individual, y la posición z está codificada por colores. Crédito:Science Advances, doi:10.1126 / sciadv.abc2508
El equipo realizó la localización en 3-D de cada nanovarilla individual en la célula y reconstruyó las trayectorias de las partículas en 100 marcos de observación para obtener seis categorías representativas. donde algunas partículas estuvieron inmóviles durante los 200 segundos de tiempo de observación, mientras que otros se difundieron libremente a través de varios micrómetros. Las partículas restantes mostraron estados unidos y difusos. De este modo, el método de holografía de fluorescencia subyacente podría determinar con precisión las posiciones tridimensionales.
Captación celular y transporte activo de vesículas extracelulares
Liebel y col. luego estudió el transporte activo en 3-D de vesículas extracelulares (EV) dentro de las células vivas incubando células HeLa con EV marcados con fluorescencia. Adquirieron hologramas fluorescentes cada cuatro segundos para reconstruir trayectorias tridimensionales de vehículos eléctricos individuales a través de una combinación de trayectorias automáticas y manuales. vincular las posiciones de EV 3-D. Liebel y col. Proyecciones de amplitud de lapso de tiempo superpuestas de hologramas fluorescentes con imágenes de campo claro grabadas simultáneamente de células individuales, para mostrar cómo la mayoría de los vehículos eléctricos se localizaron en el borde de las células adherentes. Las observaciones y los cálculos sugirieron que los vehículos eléctricos estaban atrapados dentro de un área, limitar su movimiento a un volumen específico; muy probablemente perteneciente al citoesqueleto celular.
Reconstrucción de las trayectorias tridimensionales de las vesículas extracelulares (VE) individuales dentro de las células vivas. Crédito:Science Advances, doi:10.1126 / sciadv.abc2508
panorama
De este modo, Matz Liebel y sus colegas idearon un método de holografía de fluorescencia de un solo disparo con gran campo de visión para permitir el seguimiento de una sola partícula en 3-D en un rango Z de aproximadamente ocho micrómetros. Para probar este concepto, el equipo implementó una configuración experimental sencilla con un rendimiento de fotones optimizado. Las características optimizadas permitieron que la holografía de fluorescencia fuera un enfoque ideal para estudiar el seguimiento de partículas en tiempo real. El equipo mostró un seguimiento de una sola partícula en 3-D y observó el movimiento de objetos a nanoescala en células vivas. como nanobarras de oro marcadas con fluorescencia y VE (vesículas extracelulares). Mientras que las nanovarillas de oro solo se agregan en el citoplasma sin internalización en el núcleo, los VE se acumulan en los bordes de las células adherentes en un efecto de apiñamiento. Liebel y col. esperar realizar tinciones adicionales para identificar el citoesqueleto intracelular, conectando así la arquitectura intracelular al movimiento de las vesículas extracelulares. Estos esfuerzos arrojarán luz sobre los mecanismos precisos del transporte de carga y la internalización de partículas dentro de las células con importantes aplicaciones en nanomedicina para responder preguntas críticas en biología y medicina. El mecanismo es igualmente adecuado para realizar otros métodos de imágenes volumétricas para rastrear el interior de los tejidos y para obtener imágenes bioquímicas de calcio.
© 2020 Science X Network