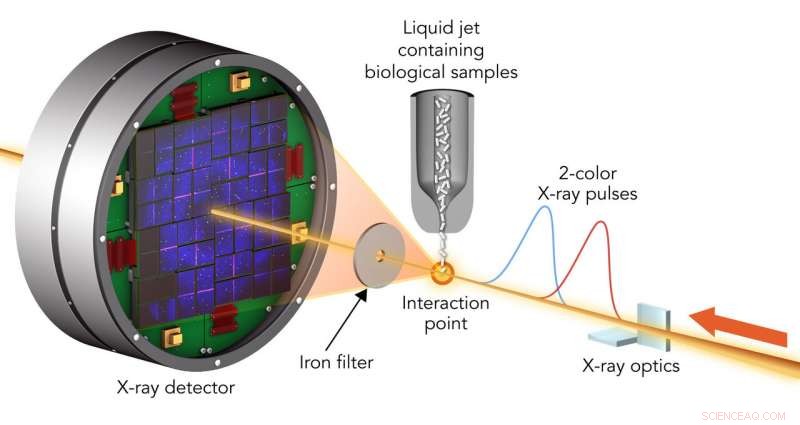
Para estudiar el daño de la muestra, los investigadores golpearon moléculas biológicas cristalizadas con pares de pulsos de láser de rayos X que tenían longitudes de onda ligeramente diferentes y estaban separadas por hasta 100 femtosegundos. El primer pulso pasó a través de la muestra y, debido a su mayor energía, fue absorbido por un filtro de aluminio. El segundo se dispersó de la muestra, pasó a través del filtro y entró en un detector. Crédito:Greg Stewart / SLAC National Accelerator Laboratory
Una de las grandes ventajas de los láseres de rayos X de electrones libres como el del Laboratorio Nacional Acelerador SLAC del Departamento de Energía es que permiten a los investigadores determinar la estructura de moléculas biológicas en ambientes naturales. Esto es importante si desea estudiar cómo un nuevo fármaco potencial interactúa con un virus en condiciones similares a las que se encuentran en el cuerpo humano. Al golpear estas muestras con pulsos de láser de rayos X ultracortos, los científicos pueden recopilar datos en el instante antes de que el daño de los rayos X tenga tiempo de propagarse a través de la muestra.
Pero, ¿hay realmente cero daños en las muestras examinadas con este método? que se conoce como "difracción antes de la destrucción"? Conocer la respuesta a escalas de medición cada vez más precisas es importante para analizar los resultados de estos experimentos y comprender cómo las moléculas biológicas hacen su trabajo. Tal comprensión es fundamental en el diseño de medicamentos para atacar eficazmente enfermedades específicas.
Gracias a una técnica láser de rayos X de dos colores desarrollada en la fuente de luz coherente Linac (LCLS) de SLAC, un experimento en LCLS está probando esta técnica hasta límites nunca antes vistos.
Un equipo dirigido por Ilme Schlichting del Instituto Max Planck de Investigación Médica y Sébastien Boutet de SLAC encontró dos tipos de moléculas biológicas cristalizadas con pares de pulsos de láser de rayos X que tenían longitudes de onda ligeramente diferentes y eran de hasta 100 femtosegundos. millonésimas de mil millonésimas de segundo, aparte. El primer pulso pasó a través de la muestra y fue absorbido por un filtro de lámina. El segundo se dispersó de la muestra, pasó a través del filtro y entró en un detector, formando patrones que podrían analizarse para recrear la estructura de las moléculas de la muestra y medir cualquier cambio causado por el primer pulso.
Con este método, El equipo descubrió que las partes de una molécula que contienen átomos más pesados que el oxígeno absorben la mayor parte del daño de los rayos X. Cadenas de átomos de carbono, que forman la columna vertebral de todas las proteínas, también vio cambios a lo largo del tiempo, pero en un grado mucho menor. Estos cambios no fueron consistentes en toda la molécula, ocurre más en ciertas áreas que en otras, y aumentaron a medida que aumentaba el tiempo entre pulsos. Estos resultados muestran que para realizar mediciones fiables, los investigadores deben modelar estas partes específicas de una muestra en lugar de asumir que todas las partes de la molécula están igualmente dañadas.
Este estudio, publicado en Comunicaciones de la naturaleza , es el comienzo de una comprensión más completa de cómo los pulsos de rayos X muy cortos producidos por láseres de rayos X como LCLS modifican la estructura de las moléculas biológicas. El equipo concluyó que la "difracción antes de la destrucción" es un método eficaz para determinar la estructura de moléculas biológicas. siempre que los científicos consideren la intensidad y duración de los pulsos utilizados para estudiarlos al interpretar sus resultados. Este conocimiento se puede aplicar a la amplia gama de estudios que se están realizando en estas instalaciones, que van desde la investigación de nuevas formas de combatir las enfermedades transmitidas por mosquitos hasta el estudio de la virulencia de patógenos mortales y el desarrollo de una mejor comprensión de los fármacos antiasmáticos.