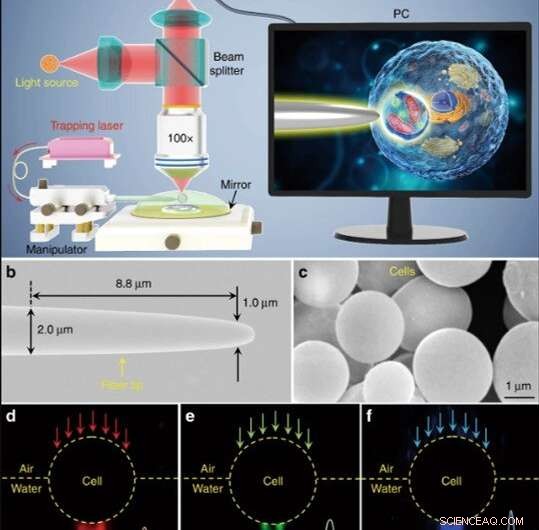
Ilustración esquemática y caracterización de materiales. (a) Ilustración esquemática de la configuración experimental. Se utilizó un microscopio de modo de reflexión convencional equipado con una cámara CCD y un objetivo × 100 para observar muestras y registrar imágenes. El recuadro que se muestra en una pantalla de PC que muestra esquemáticamente cómo se usa el biomagnificador para ampliar y obtener imágenes de las estructuras subcelulares dentro de una muestra biológica. (b) Imagen SEM de la punta de la fibra con un diámetro de 1.0 μm en su extremo ahusado. (c) Imagen SEM que muestra biomagnificadores basados en células de levadura con superficies lisas y formas esféricas. d-f Imágenes de campo oscuro que muestran luz roja de 644 nm (d), Luz verde de 532 nm (e), y luz azul de 473 nm (f) que se transmite a través del biomagnificador y se enfoca en puntos de luz de sublongitud de onda con un radio de cintura de 370, 300, y 270 nm, respectivamente. Crédito:Light:Science &Applications, doi:10.1038 / s41377-019-0168-4
Los microscopios ópticos y las pinzas pueden obtener imágenes y manipular objetos a microescala para aplicaciones en biología celular y molecular. La resolución óptica es, sin embargo, obstaculizado por el límite de difracción y, por lo tanto, tanto los microscopios como las pinzas son incapaces de obtener imágenes y manipular nanoobjetos directamente. Las técnicas emergentes en los nanoscopios plasmónicos / fotónicos y las nanotinzas tienen como objetivo lograr una resolución a escala nanométrica, aunque las estructuras de materiales de alto índice pueden causar fácilmente daños mecánicos y fototérmicos a las bioespecímenes a nanoescala.
En un estudio reciente ahora publicado en Luz:ciencia y aplicaciones , Yuchao Li y sus colegas del Instituto de Nanofotónica de China, desarrolló un sistema de microscopio óptico que utiliza células vivas como lentes diminutos para obtener imágenes y manipular objetos más pequeños que la longitud de onda de la luz. Mostraron imágenes de límite de sub-difracción y manipulación de nano-objetos con un dispositivo no invasivo, que construyeron atrapando una celda en una punta de fibra. La célula atrapada formó un biomagnificador que podría magnificar nanoestructuras con una resolución de 100 nm, bajo microscopía de luz blanca. Usando el biomagnificador, Li y col. formó una trampa nano-óptica para manipular con precisión una nanopartícula individual con un radio de 50 nm. La técnica proporciona una herramienta de alta precisión para imágenes ópticas, detección y ensamblaje de bio-nanomateriales sin daño mecánico o fototérmico.
Las imágenes ópticas para manipular objetos pequeños son cruciales para el diagnóstico médico, detección biológica, exploración celular, entrenamiento molecular y ensamblaje de materiales. Las pinzas y los microscopios son dispositivos estándar para la obtención de imágenes sin contacto y la manipulación de muestras diminutas que van desde unos pocos nanómetros hasta varios micrones. Sin embargo, Es un desafío utilizar la tecnología para obtener imágenes a nanoescala, dado que la resolución óptica está restringida a aproximadamente la mitad de la longitud de onda de iluminación.
Los científicos han logrado un progreso espectacular de los nanoscopios y nanotweezers de campo cercano en las últimas décadas para lograr imágenes ópticas con una resolución nanométrica. Estas técnicas de obtención de imágenes fueron retenidas por materiales inorgánicos de alto índice, como metales nobles y semiconductores utilizados para su fabricación, que pueden dañar mecánicamente muestras de células o tejidos biológicos durante la manipulación y obtención de imágenes de campo cercano.
Por lo tanto, los científicos investigaron esquemas de imágenes ópticas más simples basados en microesferas dieléctricas para superar el límite de difracción común a los microscopios convencionales. Si bien la técnica no tiene etiquetas y es factible, tales microesferas se basan en materiales inorgánicos artificiales como el dióxido de silicio (SiO 2 ), dióxido de titanio (TiO 2 ) y titanato de bario (BaTiO 3 ). Por lo tanto, los investigadores están interesados en desarrollar un biomaterial natural para construir un dispositivo biocompatible para la obtención de imágenes biológicas. manipulación y biomagnificación a resolución espacial a nanoescala.
(a) Ilustración esquemática de la configuración experimental. Se utilizó un microscopio de modo de reflexión convencional equipado con una cámara CCD y un objetivo × 100 para observar muestras y registrar imágenes. El recuadro que se muestra en una pantalla de PC que muestra esquemáticamente cómo se usa el biomagnificador para ampliar y obtener imágenes de las estructuras subcelulares dentro de una muestra biológica. Crédito:Light:Science &Applications, doi:10.1038 / s41377-019-0168-4 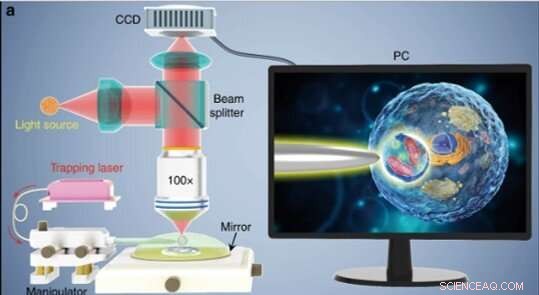
Los científicos llevaron a cabo todos los experimentos bajo un microscopio óptico de modo de reflexión acoplado a una cámara de dispositivo de carga acoplada (CCD) y un objetivo. Utilizaron fuentes de luz a 390 nm, 560 nm y 808 nm para excitación, iluminación y atrapamiento respectivamente. Usando una fibra óptica con una punta cónica, Li y col. atrapó el biomagnificador al final de la fibra, que controlaron moviendo la punta con un micromanipulador. Li y col. seleccionó celdas lisas y esféricas para minimizar la aberración de la imagen y observó que las celdas exhibían un mejor rendimiento de enfoque cuando se semi sumergían en la solución para mantener la viabilidad celular.
Rendimiento de imagen experimental de diferentes biomagnificadores. (a) Diagrama esquemático que muestra que el biomagnificador recoge las nanoestructuras de campo cercano de un objeto y forma una imagen prácticamente ampliada que puede capturarse con un microscopio óptico convencional. (b – e) Imágenes ópticas de diferentes biomagnificadores construidos a partir de bacterias (b), levadura (c), sangre roja (d), y células madre (e) que están parcialmente sumergidas en suspensión celular. f Imagen SEM de una matriz de nanoesferas de sílice compactada hexagonal bidimensional ensamblada mediante una técnica de fotoféresis. (g – j) Imágenes ópticas de la matriz de nanoesferas de sílice ampliadas mediante biomagnificadores basados en bacterias (g), levadura (h), sangre roja (i), y células madre (j). (k) Imagen SEM de la superficie de una rejilla de disco Blu-ray con un ancho de línea de 200 nm y un espaciado de 100 nm. l – o Imágenes ópticas de la estructura de rejilla de Blu-ray ampliadas mediante biomagnificadores basados en bacterias (l), levadura (m), sangre roja (n), y células madre (o). p Perfil de intensidad a lo largo de la línea de puntos a lo largo de la estructura de rejilla de Blu-ray indicada en o. q Puntos azules que muestran el factor de aumento M de las imágenes obtenidas por los biomagnificadores en función del diámetro del biomagnificador. Crédito:Light:Science &Applications, doi:10.1038 / s41377-019-0168-4 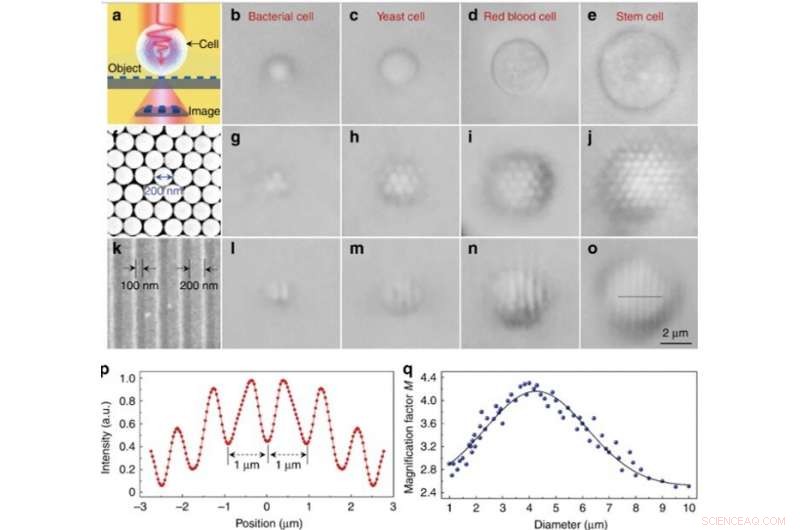
Solo las nanoesferas con biomagnificadores encima podrían resolverse durante la obtención de imágenes, mientras que las nanoesferas sin biomagnificadores no podrían resolverse con un microscopio convencional. Se determinó que el factor de aumento M de los biomagnificadores basados en células madre era 3,3 veces mayor (x3,3), y los científicos demostraron que la M experimental dependía del diámetro del biomagnificador. Después, Li y col. realizó todos los experimentos utilizando biomagnificadores de este diámetro.
Imágenes nanoópticas de estructuras subcelulares y letras con nanopatrones. (a, b) Imágenes ópticas de las estructuras subcelulares de una célula epitelial humana utilizando un microscopio óptico convencional (a) y biomagnificadores (b). Las posiciones de cuatro biomagnificadores están marcadas como A – D. Para comparacion, los biomagnificadores pueden resolver el citoesqueleto fibroso (indicado como A – C) dentro de la célula y las estructuras de dos capas (indicadas como D) en la membrana celular, que son indistinguibles por el microscopio convencional. c – e SEM (c), campo oscuro (d), e imágenes ópticas (e) de letras con nanopatrones JNU que representan el acrónimo de la Universidad de Jinan. El ancho de línea de las letras nanopatterned es 100 nm, que es menor que la resolución de límite de difracción del microscopio óptico convencional. f – h Imágenes ópticas que muestran que el biomagnificador atrapado en la punta de la fibra puede escanear y obtener imágenes de las letras J (f) con nanopatrones, N (g), y U (h) moviendo la fibra. El ancho de línea de las letras con nanopatrón se amplió de 100 a 400 nm. Crédito:Light:Science &Applications, doi:10.1038 / s41377-019-0168-4 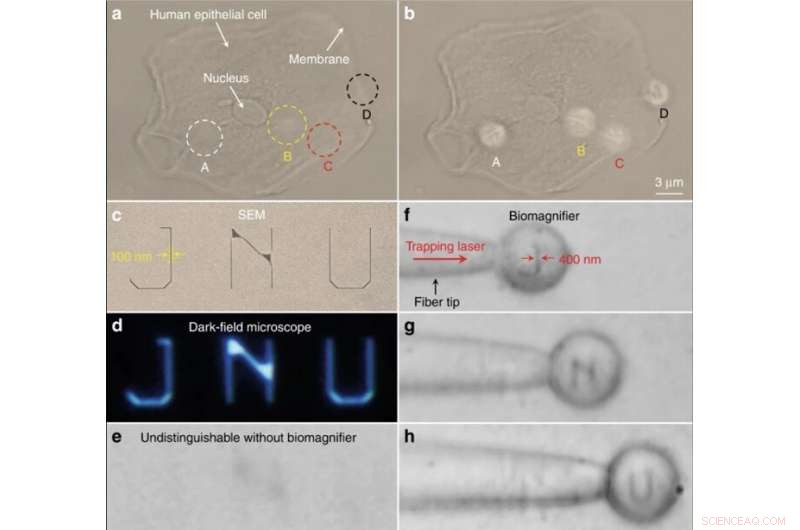
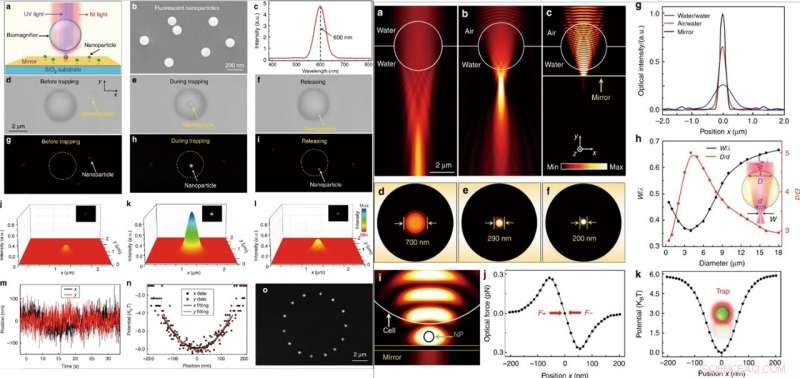
IZQUIERDA:Manipulación óptica de una única nanopartícula fluorescente. (a) Diagrama esquemático que muestra una nanopartícula fluorescente suspendida en la superficie de un espejo y atrapada por el biomagnificador. (b) Imagen SEM que muestra las nanopartículas fluorescentes de PS con un radio medio de 50 nm. (c) Espectro de emisión que muestra la longitud de onda de emisión central de las nanopartículas fluorescentes ubicadas a 600 nm. (d – f) Las imágenes ópticas muestran el proceso de captura de una sola nanopartícula de PS con el biomagnificador. El proceso constaba de tres pasos sucesivos:antes del trampeo (d), durante la captura (e), y después del lanzamiento (f). g – i Imágenes de fluorescencia que muestran la mancha de fluorescencia de la nanopartícula de PS antes de quedar atrapada (g), durante la captura (h), y después del lanzamiento (i). j – l Mapeo de color tridimensional de los puntos de fluorescencia de la nanopartícula como se muestra en g – i. m Traza en tiempo real de la posición de la nanopartícula atrapada en las direcciones xey. (n) Potencial de captura de la nanopartícula atrapada en las direcciones xey con accesorios de parábola. (o) Las imágenes de fluorescencia compuestas muestran el rastro de movimiento de la nanopartícula atrapada en el plano x – y mediante el movimiento controlado del biomagnificador. DERECHA:Simulación y cálculo numérico. (a – c) Distribuciones de intensidad óptica de la luz enfocada por un biomagnificador de 4 μm completamente sumergido en agua (a), semi sumergido en agua (b), y suspendido en la superficie de un espejo (c). La fuente de luz de iluminación se estableció como un haz gaussiano con una longitud de onda de 560 nm. (d – f) Distribuciones de intensidad óptica de los puntos de luz del biomagnificador correspondientes a (a – c) en el plano x – z. (g) Perfiles de intensidad óptica en los planos focales de la luz de salida de los biomagnificadores en la dirección x. (h) Resultados de la simulación FEM para la cintura normalizada del punto de luz w / λ (w es el radio de cintura del punto de luz y λ es la longitud de onda de la luz de entrada) y la relación D / d (el ancho de la región lineal donde la luz entra en el biomagnificador por su superficie frontal se denomina D, y la anchura del haz de luz de salida en la superficie trasera es (d) en función del diámetro del biomagnificador. (i) Distribución de intensidad simulada de luz atrapante en el infrarrojo cercano que muestra que una nanopartícula (radio:50 nm) está atrapada en el espacio entre el biomagnificador y el espejo. La potencia óptica de entrada de la luz de captura se estableció en 10 mW. (j) Fuerzas ópticas simuladas de la nanopartícula atrapada en el punto de luz en función de la posición de la nanopartícula a lo largo de la dirección x. (k) Potencial de atrapamiento calculado de la nanopartícula atrapada en función de la posición a lo largo de la dirección x. Crédito:Light:Science &Applications, doi:10.1038 / s41377-019-0168-4
Después de eso, cuando irradian simultáneamente rayos láser de infrarrojo cercano (IR) y ultravioleta en el biomagnificador a través de una lente de objetivo, podrían atrapar y excitar las nanopartículas. Para estos experimentos, los científicos utilizaron nanopartículas fluorescentes con un radio promedio de 50 nm. Cuando atraparon una sola nanopartícula en el foco de un biomagnificador, observaron imágenes tanto ópticas como fluorescentes de la muestra de interés. Li y col. luego calculó la rigidez de atrapamiento de la partícula en tiempo real usando pinzas ópticas estándar. La capacidad de manipular una sola nanopartícula sin contacto y con precisión a través de la óptica será útil para ensamblar nanoestructuras bien reguladas. Cuando Li et al. investigó numéricamente el mecanismo de obtención de imágenes y la rigidez de captura de los biomagnificadores utilizando simulación 3D y software COMSOL. Observaron que la capacidad de enfoque de la luz con límite de subdifracción era el resultado de un efecto combinado de "nanojet fotónico" y una mejora de la interferencia coherente por parte del espejo.
Las limitaciones del método incluyeron la aberración y distorsión de la imagen debido a las estructuras intracelulares no homogéneas del biomagnificador natural, en comparación con las microesferas dieléctricas con índices de refracción uniformes. Afortunadamente, Los materiales intracelulares eran ópticamente transparentes a la luz visible y al infrarrojo cercano y las interacciones ópticas eran relativamente débiles dentro de una sola célula. Las actividades intracelulares también podrían cambiar la distribución del índice de refracción parcial en una célula para causar distorsión de la luz durante la captura y la obtención de imágenes. pero la mayoría de las actividades intracelulares fueron ultrarrápidas y no influyeron en el esquema de imagen.
De este modo, Yuchao Li y sus colegas desarrollaron una nueva técnica de imagen experimental y verificaron las capacidades experimentales con simulaciones FEM. Li y col. nanoscopios ópticos y nanotweezers integrados en un solo dispositivo para obtener imágenes y manipular nanoestructuras simultáneamente por primera vez en el presente trabajo. Promovieron la resolución de la técnica a 100 nm y propusieron un procedimiento de imagen sin etiqueta. Los científicos visualizan el biomagnificador viviente para abrir nuevas oportunidades en imágenes de superresolución, detección en tiempo real y nanoensamblaje preciso de bionanomateriales para formar nanoarquitecturas de interés.
© 2019 Science X Network