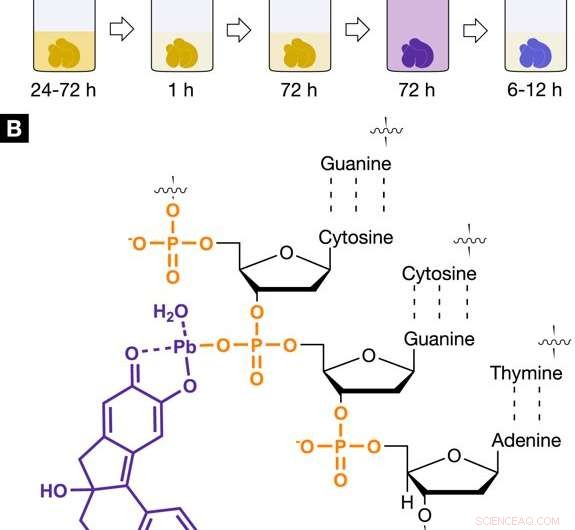
La radiografía adecuada, Protocolo de agente de tinción específico del núcleo para histología virtual 3D. Protocolo de tinción e interacción de la tinción radiográfica a base de hemateína con tejidos blandos. (A) El procedimiento de tinción desarrollado a base de hemateína muestra los pasos individuales involucrados, incluidos los tiempos de incubación y tinción. La etapa de tinción 1 se llevó a cabo utilizando trihidrato de acetato de plomo (II) como fuente de metal pesado. El acetato de plomo (II) trihidratado se disolvió en agua destilada y se denomina solución de trabajo (A) (WS (A)). El paso de tinción 2 involucró una solución de hemateína en etanol absoluto (WS (B), 10% (p / v); c =333 mM), que se derivó de la hematoxilina y se añadió a WS (A). (B) El complejo de hemateína-plomo (II) cargado positivamente (violeta), que se construye in situ en la muestra de tejido blando, está interactuando con el esqueleto de fosfato cargado negativamente del ADN (naranja) presente en el núcleo de la célula. La interacción selectiva del complejo hemateína plomo (II) con el ADN se logra mediante la acidificación del tejido blando durante la fijación o antes de la tinción y permite una mayor acumulación del complejo hemateína plomo (II) dentro del núcleo celular. Crédito: Informes científicos , doi:https://doi.org/10.1038/s41598-018-36067-y
La histología se utiliza para identificar los detalles estructurales del tejido a microescala en el laboratorio de patología. pero los análisis siguen siendo bidimensionales (2D) ya que se limitan al mismo plano. Las tecnologías 3D no destructivas, incluida la micro y nano tomografía computarizada de rayos X (nanoCT), han demostrado su validez para comprender las estructuras anatómicas, ya que permiten ángulos de visión arbitrarios y detalles estructurales en 3D. Sin embargo, la baja atenuación de los tejidos blandos ha dificultado su aplicación en el campo de la histología virtual 3D. En un estudio reciente, ahora publicado en Informes científicos , Mark Müller y sus colegas del Departamento de Física y Bioingeniería han desarrollado un método de tinción de rayos X basado en hemateína para apuntar específicamente a los núcleos de las células. seguido de demostraciones en un lóbulo hepático completo de un ratón.
El nuevo protocolo de tinción combinó el recientemente desarrollado, Sistema nanoCT de alta resolución para visualización 3D de la arquitectura de tejidos a escala nanométrica. Los resultados revelaron la morfología real en 3D junto con la distribución espacial de los núcleos celulares. La técnica también fue compatible con la histología convencional, ya que los portaobjetos microscópicos con muestra de tejido blando podrían teñirse con el mismo protocolo junto con tinción adicional. El método demostró la posibilidad de futuras aplicaciones en histopatología acompañadas de dispositivos de TC de rayos X en el laboratorio.
La histología es el estándar de oro existente para un diagnóstico microanatómico preciso en el laboratorio de patología. sin embargo, las técnicas y los resultados se limitan a 2D. Por ejemplo, Por lo general, una biopsia 3D se examina utilizando portaobjetos microscópicos muy delgados (que contienen cortes de 2 a 10 µm de grosor) mediante técnicas de tinción inmunohistoquímica e histológica convencionales y modernas. La micro y nano-TC son herramientas poderosas que pueden proporcionar una reconstrucción precisa de tejido en 3D. Los avances en la tecnología han permitido una resolución comparativamente alta a la histología convencional 2D existente, utilizando dispositivos que van desde grandes aceleradores de partículas hasta dispositivos de rayos X de laboratorio.
Junto con los requisitos técnicos, Agentes de tinción adecuados para rayos X (agentes de contraste) como el ácido fototúngstico (PTA), yoduro de yodo y potasio (IKI), yodo en etanol (12E), o yodo en metanol (12 M) también son importantes. Los agentes colorantes disponibles son, sin embargo, actualmente limitado en alcance y eficacia. Al desarrollar diagnósticos médicos de próxima generación en histopatología, los científicos tienen como objetivo optimizar las técnicas y comprender la arquitectura de los tejidos desde el nivel celular hasta la escala del tejido.
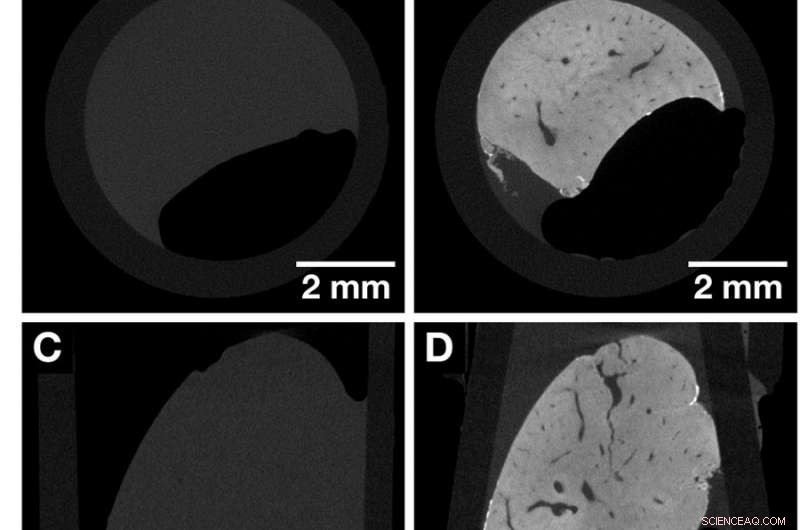
Cortes de TC del mismo lóbulo de hígado de ratón completo antes y después de la tinción, destacando la mejora del contraste obtenida después de la aplicación de la tinción de rayos X a base de hemateína. Ambos conjuntos de datos se adquirieron con el Xradia Versa 500 microCT utilizando parámetros de adquisición idénticos. El tamaño del vóxel en ambos conjuntos de datos es 13,5 µm. (A, C y E) Imágenes generales del lóbulo del hígado de ratón sin teñir que representan las vistas a lo largo de los ejes cartesianos. (B, D y F) Imágenes generales de la misma muestra de lóbulo hepático de ratón en (A, C y E) después de la tinción que representan las vistas a lo largo de los ejes cartesianos. Se visualizan estructuras anatómicas como la vasculatura. Crédito: Informes científicos , doi:https://doi.org/10.1038/s41598-018-36067-y.
Durante el primer diagnóstico en patología clínica, los núcleos celulares y el citoplasma son importantes. Por lo tanto, casi todas las muestras histológicas se tiñen a menudo mediante el protocolo estándar de hematoxilina y eosina (H&E) para identificar los núcleos y el citoplasma. Pero los estándares para la tinción de hematoxilina no son fijos y existen muchas variantes del protocolo debido a los diversos tipos de tejidos y / o parámetros previos al tratamiento involucrados. Como resultado, Müller y col. introdujo un protocolo de tinción basado en hemateína, desarrollado específicamente para CT, para permitir la visualización directa en 3D de núcleos celulares en muestras de tejidos blandos. El poderoso potencial de microCT o nanoCT combinado con tinciones adecuadas para rayos X permitirá conocer en el futuro la organización de los tejidos para comprender enfermedades como la osteoartritis y el cáncer. en la nanoarquitectura celular.
Al desarrollar la nueva radiografía adecuada, colorante a base de hemateína, la hematoxilina de Mayer de uso común y la hematoxilina de hierro de Wiegert se incluyeron en su constitución. Los experimentos de tinción se realizaron en el tejido del lóbulo del hígado de ratón, utilizado para la obtención de imágenes por TC de rayos X a partir de entonces. El protocolo de tinción optimizado contenía cinco pasos comenzando con la acidificación controlada de las muestras de tejidos blandos durante la fijación. El tejido blando se preparó a nivel molecular para teñir con el complejo de hemateína-plomo (II).
En su mecanismo de acción, los científicos demostraron una interacción iónica reforzada entre el complejo de hemateína-plomo (II) cargado positivamente y el esqueleto de fosfato cargado negativamente del ácido desoxirribonucleico (ADN). La reacción química aseguró una mayor acumulación del agente de tinción dentro de los núcleos celulares al formar un complejo de ADN de hemateína-plomo (II), como agente adecuado para rayos X.

Datos NanoCT (A – C) en comparación con el portaobjetos microscópico histológico (D) derivado del mismo lóbulo hepático de ratón después de la aplicación del protocolo de tinción de rayos X basado en hemateína. Se logró una visualización clara de los núcleos de las células de los hepatocitos más grandes y los núcleos de las células más pequeñas, como las células de Kupffer y los SEC en blanco (A – C) o púrpura oscuro (D) y la red BC mostrada en negro (A-C) o blanco (D), respectivamente. (A) El volumen de interés (VOI) destacando las dos rebanadas nanoCT que se muestran en (B, marco azul) y (C, marco naranja). (B, C) Rebanadas de nanoCT individuales representativas como se indica en el VOI de (A). (B) y (C) se colocan ortogonales entre sí. La orientación de la red BC, que está formado por los hepatocitos, es decir, se ve una disposición más horizontal en (B) y una alineación más vertical en (C). El grosor del corte de nanoCT es de 580 nm. (D) Portaobjetos microscópico histológico representativo con un grosor de 3 µm obtenido de la misma muestra de lóbulo de hígado de ratón después de aplicar la tinción a base de hemateína e incrustarla en un bloque de parafina. Crédito: Informes científicos , doi:https://doi.org/10.1038/s41598-018-36067-y.
Para comparar la eficacia de la tinción, se obtuvieron imágenes del tejido del lóbulo hepático del ratón con microCT antes de la tinción, seguido de la obtención de imágenes después de la tinción basada en el protocolo de hemateína. El proceso de tinción se produjo en dos pasos y la mejora de contraste deseada se logró como se esperaba después de la tinción. Los resultados se observaron utilizando la descripción general de microCT para mostrar distintas estructuras anatómicas, incluyendo la vasculatura. La tinción fue homogénea en todo el lóbulo del hígado del ratón, a diferencia de los ejemplos anteriores en grandes muestras de tejido hepático. El proceso de obtención de imágenes en 3D permitió la accesibilidad a una serie de cortes de TC en planos arbitrarios. Es más, a diferencia de la histología 2D convencional (con tejido blando incluido en parafina), el tejido blando se puede ver desde diferentes ángulos.
A continuación, se investigó el tejido a nivel subcelular con piezas más pequeñas del mismo lóbulo hepático, que fueron disecados y analizados usando nanoCT. Los resultados visualizados mostraron regiones del volumen de interés (VOI), núcleos celulares de los hepatocitos y núcleos de otros tipos de células (células de Kupffer y células endoteliales sinusoidales). Las estructuras enteras negras representaban la red canalicular biliar (BC), mientras que los valores grises más oscuros indicaban el citoplasma de la muestra de tejido hepático. También se observó la orientación de la red BC. Luego, el tejido se investigó con histología convencional, utilizando portaobjetos microscópicos muy delgados sin otra tinción aparte de la tinción a base de hemateína aplicada. La técnica convencional confirmó de manera similar la morfología de los hepatocitos y de otros tipos de células (núcleos teñidos de púrpura oscuro), mientras que la red BC se tiñó de blanco.
Núcleos 3D y análisis de diferentes núcleos celulares presentes en el volumen de interés del hígado de ratón (VOI). Crédito: Informes científicos , doi:https://doi.org/10.1038/s41598-018-36067-y.
Los científicos confirmaron comparativamente la precisión de la reconstrucción de datos 3D en el estudio con investigaciones anteriores. Cuando el procedimiento basado en hemateína se volvió a aplicar en las investigaciones de histología 2D convencionales, los científicos también aplicaron una contratinción estándar, específico de eosina Y, al citoplasma celular sobre el tejido. En los resultados, los núcleos celulares permanecieron morados mientras que el citoplasma tomó la mancha rosa. De este modo, Los científicos también autenticaron la capacidad de tinción basada en hemateína específica de núcleos con histología estándar.
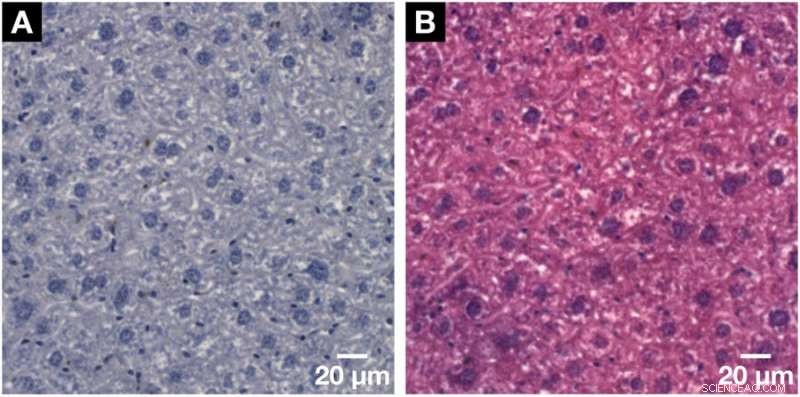
Demostración de la compatibilidad histológica del método de tinción basado en hemateína desarrollado para microCT y nanoCT con histología 2D convencional. (A) Portaobjetos microscópico histológico representativo con un grosor de 3 µm obtenido de la misma muestra de lóbulo de hígado de ratón después de la tinción aplicada a base de hemateína e incrustación en un bloque de parafina. Visualización clara de los núcleos de células de hepatocitos más grandes y los núcleos de células más pequeñas, como las células de Kupffer y los SEC en púrpura oscuro y la red BC mostrada en blanco. (B) La compatibilidad con la contratinción estándar de eosina Y se mostró en un portaobjetos microscópico posterior visto en (A). Los núcleos celulares se muestran en púrpura junto al citoplasma en rosa, lo que da como resultado un portaobjetos microscópico teñido con H&E típico de una muestra de tejido blando. Crédito: Informes científicos , doi:https://doi.org/10.1038/s41598-018-36067-y.
El protocolo de tinción basado en hemateína ayudó a la visualización de TC de alta resolución para núcleos celulares en tejidos blandos en el rango submicrónico, hasta ahora no era posible con otros métodos de tinción que se combinaban con la tecnología microCT. Los estudios histopatológicos futuros pueden eliminar los procedimientos de preparación que requieren mucho tiempo y la pérdida de muestras de tejido (como se ve con la histología estándar) para obtener cortes de tejido individuales mediante la investigación en 3D de un VOI completo. como se demuestra en el presente estudio. La capacidad de analizar una muestra más grande en busca de núcleos de células anormales podría ayudar a los patólogos a identificar regiones de inflamación para evaluar la etiología y la progresión de la enfermedad.
El protocolo de tinción es simple y reproducible, adecuado para tinción CT de órganos completos, junto con visualización 3D y en profundidad, análisis no destructivo de muestras de tejidos blandos. Los agentes de tinción enumerados en el protocolo son de fácil acceso, mientras que el protocolo adecuado de rayos X combinados de TC permite una mayor sofisticación para los análisis de muestras de tejidos blandos. Los pasos del protocolo de tinción requerirán una mayor optimización con diferentes tipos de tejidos y en diversas aplicaciones. incluyendo histología 3D, estudios de biología estructural y del desarrollo en el laboratorio.
© 2018 Science X Network