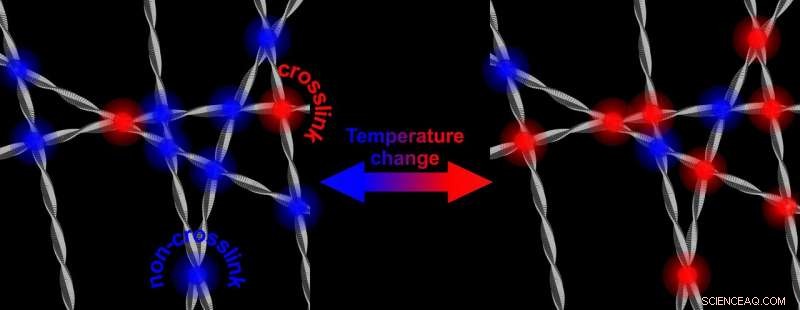
A temperaturas más altas, hay más enlaces cruzados que endurecen la red de fibrillas de proteínas. Bajar la temperatura da como resultado una red que vuelve a ser menos rígida. Crédito:Universidad de Twente
Fibrillas de la proteína alfa-sinucleína, que juega un papel en la enfermedad de Parkinson, formar una red más rígida y fuerte en el agua, cuando la temperatura aumenta. Investigadores de la Universidad de Twente muestran que esto tiene que ver con la parte repelente al agua de las fibras que salen a la superficie e interactúan. El mecanismo también podría desempeñar un papel en la interacción con las células sanas. Investigadores de la Universidad de Twente publican al respecto en Cartas de revisión física del 17 de mayo.
La alfa-sinucleína abunda en nuestro cerebro. Se sabe que puede volverse en nuestra contra:en enfermedades neurodegenerativas como el Parkinson, la proteína muestra un comportamiento aberrante:después de formar fibrillas, la proteína puede formar placas. Aún no se sabe cómo funciona este mecanismo. La investigación ahora presentada por los científicos de UT, muestra que las propiedades de la alfa-sinucleína son "ajustables". En el laboratorio, en agua, Formarán una red más rígida y fuerte cuando aumente la temperatura. Bajando la temperatura de nuevo, la red se vuelve menos rígida nuevamente. Aunque todo esto ocurre en un rango de temperatura que nunca ocurrirá en el cerebro, el mecanismo subyacente podría brindar más información sobre el papel que desempeñan las proteínas en la aparición de la enfermedad. La rigidez ajustable es inducida por una "interacción hidrófoba":la parte de las fibras que repele el agua es la clave.
La investigación que ahora se presenta en Cartas de revisión física , muestra que el fortalecimiento de la red es causado por un aumento del número de puntos de contacto de las fibrillas. Todos estos puntos de contacto se encuentran en las partes hidrófobas de la alfa-sinucleína. La razón por la que esto es notable, es que la parte hidrofóbica normalmente está "protegida" por los otros dos componentes básicos de la proteína:una parte con carga eléctrica y una parte que es anfifílica (le gusta tanto el agua como los lípidos). Quitando este escudo y abriendo la parte hidrofóbica, también puede desempeñar un papel en la enfermedad:esta parte es capaz de dañar las células sanas.
Incluso los propios mecanismos de defensa naturales del ser humano pueden actuar en nuestra contra, en este caso. Investigaciones anteriores mostraron que la 'limpieza' de las proteínas hostiles se realiza típicamente 'recortando' la parte que está cargada eléctricamente, quitando así el escudo de la parte hidrofóbica. Las fibrillas ahora pueden encontrar puntos de contacto, forman redes y atacan las membranas celulares. De este modo, se quita la protección natural.
La investigación ayuda a comprender los mecanismos, pero también puede inspirar, p. ej. nanotecnólogos para la creación de nuevos tipos de estructuras artificiales que se pueden ajustar. A primera vista, el endurecimiento de la red se conoce a partir de polímeros, pero la interacción hidrofóbica es un mecanismo completamente diferente que también podría usarse en estructuras artificiales.