Cada modelo sucesivo de anatomía y construcción atómica se basó en el anterior. Filósofos, teóricos, físicos y científicos desarrollaron progresivamente el paradigma atómico a lo largo de muchos siglos. Se propusieron, modificaron y finalmente rechazaron o aceptaron varios modelos hipotéticos. Muchos científicos y pensadores hicieron descubrimientos y realizaron experimentos para llegar al modelo atómico actualmente aceptado. El desarrollo de las matemáticas y la tecnología especializada contribuyó en gran medida a la comprensión contemporánea de la naturaleza de los átomos.
Primeros modelos esféricos
Debido a que los átomos son demasiado pequeños para ser vistos, los primeros modelos teóricos fueron construcciones intelectuales basadas en el Métodos lógicos de razonamiento inductivo y deductivo. El filósofo griego clásico Demócrito fue el primero en proponer la existencia de átomos en el 400 a. C. Razonó que la materia no puede dividirse indefinidamente y debe consistir en partículas redondas indivisibles llamadas átomos. En 1800, John Dalton llegó a la misma visión del atomismo utilizando el método experimental para estudiar gases y compuestos. Su teoría se llamaba modelo de esfera sólida o bola de billar.
Modelo de pudín de ciruela
En 1904, el físico británico J.J. Thompson postuló el pudín de ciruela, o bollo de pasas, modelo de atomismo. Se basó en el conocimiento de las partículas subatómicas cargadas negativamente recientemente descubiertas llamadas electrones. Los experimentos de Thompson con tubos de rayos catódicos lo llevaron a teorizar la existencia de pequeñas partículas dentro de los átomos que eran partes fundamentales de todos los átomos. Su modelo imaginó los electrones negativos, o ciruelas, suspendidos dentro de un marco cargado positivamente, o el pudín. Dos modelos de órbita planetaria
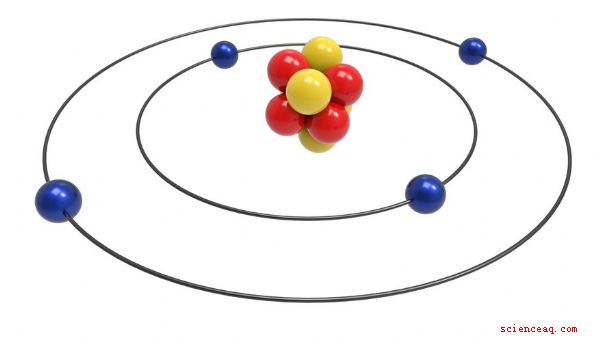
De 1910 a 1911, Ernest Rutherford propuso el modelo planetario o nuclear de El átomo. Él creía que los átomos estaban compuestos principalmente de espacio vacío, con un núcleo denso. Sus experimentos involucraron disparar partículas alfa en papel de oro. Llegó a la conclusión de que el núcleo positivo contiene la mayor parte de la masa del átomo. Con su modelo de órbita, Niels Bohr refinó la idea del átomo como un pequeño sistema solar en 1913. El modelo de Bohr tenía electrones orbitando el núcleo en capas con forma de caparazón.
Modelo de nube de electrones
Louis de Broglie y Erwin Schrodinger desarrolló el modelo de nube electrónica o mecánica cuántica. Basaron el modelo en los avances de la rama de la mecánica cuántica de la física. En lugar de electrones en órbitas fijas, el modelo de nube tiene las órbitas definidas por una distribución de probabilidad alrededor del núcleo. Dependiendo de su observación y medición, los electrones podrían estar en muchos lugares diferentes, a veces simultáneamente.