Antes de que los investigadores puedan desarrollar medicamentos dirigidos, necesitan saber exactamente cómo funciona una enfermedad. El bioquímico Bert Beerkens creó moléculas que les permiten averiguarlo. Utilizó la cafeína como base para nuevas moléculas que permiten la investigación de ciertas proteínas receptoras en las células.
Como estudiante de química, Bert Beerkens quedó fascinado por el campo de investigación que permite utilizar la química para estudiar todo tipo de procesos en el cuerpo. "Luego se diseñan y producen moléculas que no tienen ningún efecto medicinal, pero que ayudan a otros investigadores en su trabajo sobre una enfermedad concreta."
En su doctorado. En su investigación, Beerkens se puso a trabajar para crear moléculas que se unieran a una proteína que normalmente se une a la sustancia adenosina. La adenosina está en todas partes de nuestro cuerpo. Forma parte del ADN y también del ATP:trifosfato de adenosina. Esto almacena energía en todas las células vivas y la pone a disposición donde se necesita.
Beerkens dice:"La adenosina también es una sustancia de señalización para la comunicación entre células. Si hay mucha adenosina alrededor de una célula, podría significar que una célula en el área ha muerto". Luego, la adenosina se desplaza desde el ATP degradado y una célula vecina la capta con receptores especiales en la membrana celular. "Dependiendo del tipo de célula que capta la adenosina, el resultado puede ser que se inhiba la respuesta inmune. Algunos tumores abusan de este mecanismo al producir activamente receptores de adenosina".
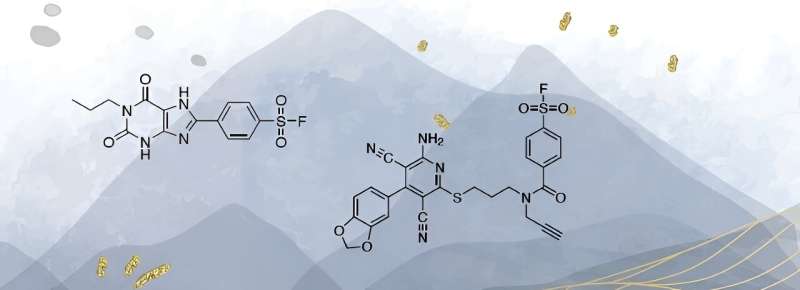
Para investigar esto, se necesitan moléculas que, como la adenosina, se unan a los receptores de adenosina. Beerkens aceptó el desafío. La cafeína se convirtió en la base de las sustancias que desarrolló. "La cafeína también se une al receptor, pero no con mucha fuerza".
Beerkens experimentó con grupos atómicos adicionales sustituidos en la molécula de cafeína. Logró crear moléculas que no sólo se unen estrechamente al receptor, sino también únicamente a este tipo de receptor y no a ningún otro. "Hay cuatro receptores de adenosina diferentes. Para tres de ellos pude diseñar moléculas adecuadas. Para el cuarto, mi predecesor ya lo hizo."
Las moléculas no sólo tenían que unirse fuerte y selectivamente al receptor, sino que también debían colocarle una etiqueta molecular. "Entonces los investigadores pueden ver si qué tipo de receptor está presente y dónde". Esa observación también tenía que ser factible en material celular vivo, es decir, sin altas dosis de radiación radiactiva.
Este fue un punto complicado en el proyecto de Beerkens. "Lo logramos utilizando la química del clic". El año pasado, el Premio Nobel de Química fue para el desarrollo de este tipo de química. "Funciona como Lego. Cuando la molécula similar a la cafeína se une al receptor de adenosina, otra molécula que emite luz, por ejemplo, hace clic en ella."
Beerkens recibió su doctorado. en noviembre, ya que sus resultados se habían publicado antes. ¿Hay una avalancha inmediata de investigadores que utilizan las moléculas? "Hace seis meses llegó una solicitud de EE.UU. Un hospital quería investigar una enfermedad en la que la adenosina parece desempeñar un papel. Además, esto todavía ocurre principalmente dentro y alrededor de nuestro laboratorio, junto con LUMC. Se trata de investigación en los receptores de adenosina en ciertas células inmunes, para ver cuál sería un buen objetivo sobre el cual actuarían los medicamentos".
Más información: Perfilado basado en afinidad de los receptores de adenosina. Scholarlypublications.universi... /handle/1887/3656497
Proporcionado por la Universidad de Leiden