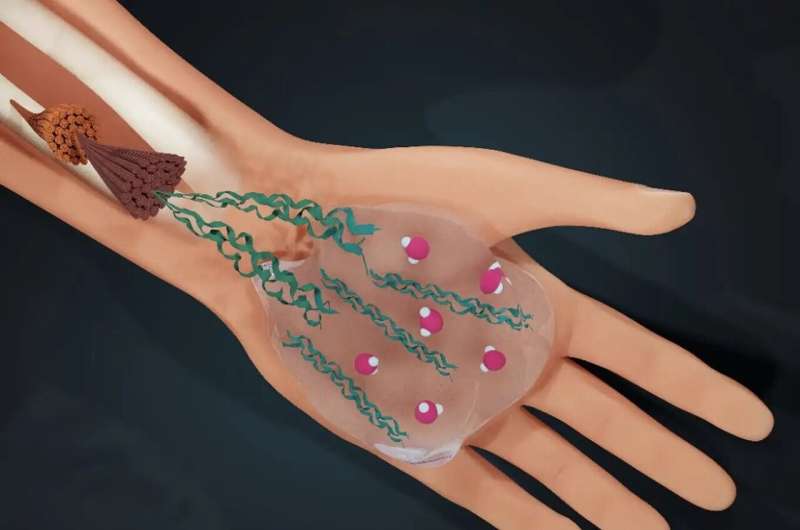
El agua determina la vida:los humanos somos tres cuartas partes de agua. Un equipo de investigación internacional dirigido por la Universidad de Ámsterdam (UvA) ha descubierto cómo el agua también determina la estructura del material que nos mantiene unidos:el colágeno.
En un artículo publicado en PNAS , los investigadores aclaran el papel del agua en el autoensamblaje molecular del colágeno. Muestran que al reemplazar el agua con su agua pesada de 'molécula gemela' (D2 O), se puede "sintonizar" la interacción entre las moléculas de colágeno y así influir en el proceso de autoensamblaje del colágeno. Los hallazgos ayudarán a comprender mejor las fallas tisulares resultantes de enfermedades hereditarias relacionadas con el colágeno, como la enfermedad de los huesos de cristal (osteogénesis imperfecta).
Como dice la autora principal, Dra. Giulia Giubertoni, del Instituto Van 't Hoff de Ciencias Moleculares (HIMS) de la UvA:"Al estudiar estas y otras enfermedades del colágeno, muchos investigadores, incluyéndome a mí,... siempre hemos pasado por alto una parte importante de la rompecabezas, y la posibilidad de que la falla del tejido pudiera deberse en parte a la interacción agua-colágeno no se tomó muy en serio. Ahora demostramos que perturbar la capa de agua alrededor de la proteína, aunque sea muy levemente, tiene efectos dramáticos en el ensamblaje del colágeno".
Giubertoni quiere concienciar a los investigadores de la comunidad de enfermedades del colágeno de que cambios muy sutiles en la interacción agua-colágeno podrían contribuir a las enfermedades del colágeno. Estos cambios pueden deberse, por ejemplo, a mutaciones en la proteína de colágeno que se producen en enfermedades genéticas. Los investigadores también sugieren que las interacciones alteradas entre el agua y el colágeno son un factor que contribuye a diversas enfermedades relacionadas con la edad que implican disfunción tisular.
El colágeno es en gran medida "la materia de la que estamos hechos":alrededor de un tercio de todas las proteínas de nuestro cuerpo es colágeno, que garantiza la integridad mecánica de todo el tejido conectivo humano.
Por ejemplo, nuestra piel y arterias se estiran sin desgarrarse y nuestros huesos pueden resistir tensiones elevadas sin romperse. Nuestras células producen colágeno como proteínas individuales que se ensamblan en estructuras más grandes llamadas fibrillas. Estas fibrillas se ensamblan en redes que forman los andamios de nuestros tejidos.
Dado que el colágeno se forma en el ambiente acuoso de las células humanas, el agua juega un papel crucial en su ensamblaje. La interacción de las moléculas de agua con las proteínas da como resultado el colágeno más adecuado para su función. Pero, ¿qué hay exactamente detrás de esta función del agua para optimizar el colágeno? ¿Cómo lo hace el agua? ¿Y comprender este mecanismo ofrecerá información sobre las condiciones en las que algo anda mal con el colágeno, como la osteogénesis imperfecta? Estas fueron las preguntas centrales de la investigación publicada en PNAS .
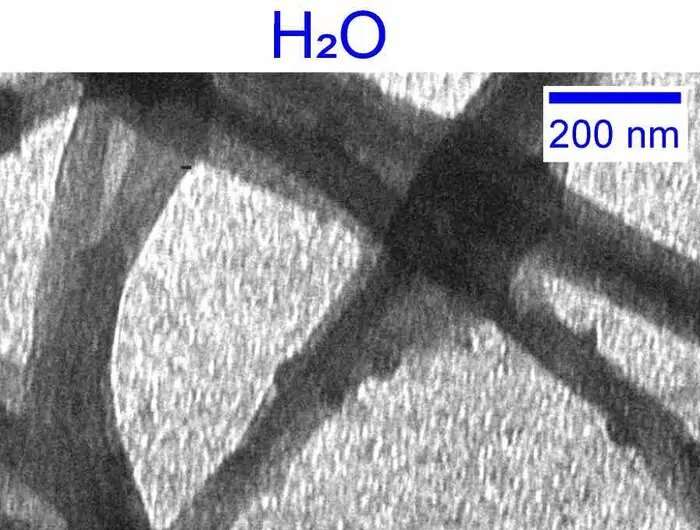
Introducción de agua pesada
Para investigar el papel del agua en la formación de colágeno, Giubertoni, junto con su colega de la UvA, el profesor Sander Woutersen, y su colaborador, el profesor Gijsje Koenderink (Universidad Tecnológica de Delft), decidieron reemplazar el agua con su 'molécula gemela' más pesada, D 2 O. Descubierto inicialmente por el premio Nobel Harold Urey en 1931, en D2 O los átomos de hidrógeno (H) del agua se reemplazan por el isótopo deuterio (D) que tiene un neutrón añadido en su núcleo. D2 O o 'agua pesada' es, por lo tanto, el 'reemplazo más cercano' al agua ordinaria en la naturaleza.
Sin embargo, en interacción con proteínas, D2 O es menos potente que H2 O. Esto se debe a que los enlaces entre D2 Las moléculas de O (los llamados enlaces de hidrógeno) son más fuertes que las que se encuentran entre H2 Oh moléculas. Esto afecta la interacción con proteínas como el colágeno.
Giubertoni, Woutersen y Koenderink estaban interesados en estudiar el efecto que esto tendría sobre el ensamblaje del colágeno. Junto con una red de investigación colaborativa multidisciplinaria, pudieron establecer que el uso de agua pesada da como resultado una formación de colágeno diez veces más rápida y, en última instancia, una red de fibras de colágeno menos homogénea, más suave y menos estable.
La explicación es que la interacción reducida del agua pesada con la proteína de colágeno hace que sea más fácil para la proteína "sacudirse" el D2 O moléculas y reorganizarse.
Esto estimula la formación de la red de colágeno, pero también da como resultado una red de colágeno más descuidada y menos óptima. El agua actúa así como mediador entre las moléculas de colágeno, ralentizando el ensamblaje para garantizar las propiedades funcionales de los tejidos vivos.
Este descubrimiento ofrece nuevas perspectivas sobre cómo el agua influye en las características del colágeno, permitiendo ajustes precisos en las propiedades mecánicas de los tejidos vivos. También crea nuevas vías para crear materiales a base de colágeno donde las propiedades macroscópicas pueden controlarse y ajustarse mediante variaciones sutiles en la composición del disolvente, en lugar de realizar cambios significativos en la estructura química de los componentes moleculares.
En el futuro también se podría utilizar un enfoque "de investigación" similar para dilucidar el papel del agua a la hora de impulsar y guiar el ensamblaje de otras proteínas capaces de ensamblarse en estructuras más grandes. Giubertoni pasará a estudiar cómo los defectos del colágeno afectan su interacción con el agua y qué papel juega esto en el fallo del tejido en las enfermedades del colágeno.
Más información: Giulia Giubertoni et al, Aclaración del papel del agua en el autoensamblaje del colágeno mediante la modulación isotópica de la hidratación del colágeno, Actas de la Academia Nacional de Ciencias (2024). DOI:10.1073/pnas.2313162121
Información de la revista: Actas de la Academia Nacional de Ciencias
Proporcionado por la Universidad de Ámsterdam