Los péptidos son hebras cortas de aminoácidos que se utilizan cada vez más con fines terapéuticos, como biomateriales y como sondas químicas y biológicas. Sin embargo, la capacidad de aislar, manipular y marcar péptidos y proteínas más grandes está limitada por la capacidad de unir de manera confiable moléculas funcionales, como compuestos fluorescentes, a péptidos en ubicaciones que no afectarán la estructura tridimensional y la función de las moléculas cortas. cadena de aminoácidos.
Los investigadores están más interesados en agregar moléculas funcionales al extremo N, o al final de un péptido con un grupo amino libre (NH2 ), de una cadena de aminoácidos para minimizar la interferencia de moléculas funcionales con la estructura y función del péptido unido.
Los métodos anteriores para unir moléculas funcionales al extremo N de los péptidos eran insuficientes por varias razones:(1) los grupos funcionales se liberarían del péptido en condiciones fisiológicas humanas, (2) sólo se podía unir un grupo funcional a un péptido en una tiempo, (3) la unión de moléculas funcionales a péptidos no fue uniforme, o (4) las reacciones simplemente no fueron eficientes.
Para abordar este problema, investigadores de la Universidad de Tohoku y la Universidad de Chuo desarrollaron una reacción química única para unir dos moléculas funcionales distintas al extremo N de un péptido con un aminoácido de glicina en el extremo N. Los investigadores publicaron su estudio en la edición del 28 de enero de 2024 de la revista Angewandte Chemie International Edition. .
"El desafío [en la modificación de las estructuras peptídicas] radica en lograr una modificación selectiva del sitio, particularmente en presencia de residuos de lisina altamente reactivos. Nuestro enfoque se destaca por su capacidad para funcionalizar exclusivamente el extremo N de los péptidos, independientemente de los residuos de lisina, lo que resulta en en conjugados estructuralmente uniformes con altos rendimientos.
"Además, el protocolo de tres componentes facilita la instalación simultánea de dos moléculas funcionales en un péptido", afirmó Kazuya Kanemoto, autor principal del artículo y profesor asistente en la Escuela de Graduados en Ciencias Farmacéuticas de la Universidad de Tohoku en Japón.
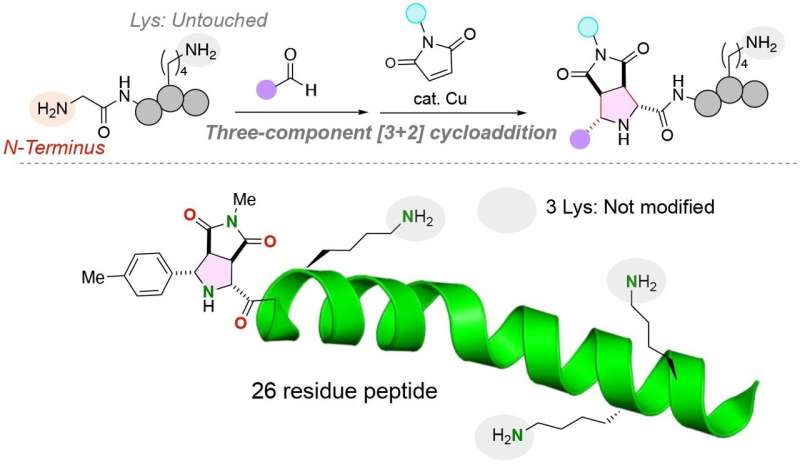
El equipo unió con éxito las dos moléculas funcionales distintas al aminoácido glicina mediante el uso de un catalizador de cobre en una reacción de tres componentes de péptidos, aldehídos (cualquier compuesto orgánico con un átomo de carbono que comparte un doble enlace con un átomo de oxígeno, un enlace simple con un átomo de hidrógeno y un enlace simple con otro átomo) y maleimidas, moléculas que son importantes componentes básicos en las reacciones de síntesis orgánica.
Sorprendentemente, la reacción se realiza en un solo recipiente en condiciones suaves, lo que resulta en una reacción muy eficiente con enlaces carbono-carbono estables entre el extremo N del péptido y las moléculas funcionales.
Los aminoácidos de lisina, en particular, han complicado la adición de moléculas funcionales al extremo N de los péptidos. El grupo funcional de los aminoácidos de lisina es un grupo amina que potencialmente podría competir con el grupo amina presente en el extremo N de una cadena peptídica. Es importante destacar que la reacción química desarrollada por el equipo de investigación marca solo el grupo de péptidos anime del extremo N, incluso si un aminoácido de lisina, que contiene un grupo amino alternativo, está presente en el péptido.
El equipo de investigación descubrió que la unión N-terminal de grupos funcionales a péptidos podría optimizarse para una variedad de di, tri y oligopéptidos, lo que demuestra la utilidad potencial de la reacción para marcar diversos péptidos y proteínas potencialmente más grandes para purificación, detección y otros fines. .
Los investigadores ya están probando la función de los péptidos que han sido modificados mediante su nueva reacción para determinar la idoneidad del producto final para diversos fines terapéuticos y de investigación.
"Nuestros pasos posteriores implican evaluar la actividad biológica de los péptidos preparados mediante esta reacción. Además, pretendemos ampliar la aplicación de este protocolo de modificación dual selectiva de sitio a péptidos más grandes, como proteínas y anticuerpos, lo que resulta prometedor para avances en la administración de fármacos". dijo Kanemoto.
Más información: Haruka Machida et al, Modificación dual específica del terminal N de péptidos mediante cicloadición [3+2] catalizada por cobre, Angewandte Chemie International Edition (2024). DOI:10.1002/anie.202320012
Proporcionado por la Universidad de Tohoku