Los investigadores han descubierto formas de convertir medicamentos contra el cáncer dirigidos al estilo inhibidor en pequeñas moléculas conocidas como degradadores, que ayudan a destruir las proteínas que promueven el cáncer en las células.
Los científicos seleccionaron moléculas que se sabe que inhiben ciertas proteínas (deteniendo su función) y las modificaron de varias maneras para convertirlas en degradadores de proteínas, que descomponen la proteína.
Otros científicos ahora pueden replicar este novedoso enfoque para desarrollar y optimizar una variedad de degradadores de proteínas. A largo plazo, esto puede ayudar a hacer que los tratamientos contra el cáncer existentes sean más efectivos y a crear nuevos tratamientos dirigidos a diferentes proteínas involucradas en el cáncer, incluidas proteínas que anteriormente podrían haberse considerado "no farmacológicas".
La investigación, dirigida por investigadores del Instituto de Investigación del Cáncer de Londres, se publica en ACS Chemical Biology. .
Científicos de todo el mundo han estado investigando la degradación selectiva de proteínas como una forma de eliminar proteínas específicas que se sabe que desempeñan un papel en el desarrollo o la progresión del cáncer. Las células descomponen naturalmente las proteínas dañadas o innecesarias, y es posible secuestrar este proceso introduciendo las moléculas de fármacos adecuadas para que las células destruyan las proteínas cancerosas.
El ICR se compromete a investigar la degradación específica de proteínas como forma de descubrir nuevos tratamientos contra el cáncer. En 2022, una importante donación filantrópica hizo posible abrir un nuevo Centro de Degradación de Proteínas dentro del Centro de Descubrimiento de Medicamentos contra el Cáncer del ICR.
Los investigadores ya han logrado cierto éxito utilizando proteólisis dirigida a quimeras (PROTAC). Estos se unen tanto a la proteína de interés como a una enzima llamada ubiquitina ligasa E3 para acercar las dos. Luego, la enzima marca la proteína con ubiquitina, lo que la marca para que la célula la destruya.
Sin embargo, el peso molecular relativamente alto de los PROTAC limita su uso, ya que no se disuelven bien en agua y pueden tener dificultades para ingresar a las células en una concentración lo suficientemente alta como para ser efectivos. Por el contrario, si la concentración es demasiado alta, todos los PROTAC se unen solo a uno de los dos compuestos (la enzima o la proteína objetivo) en lugar de a ambos, lo que significa que la degradación de la proteína es incompleta.
Un descubrimiento más reciente ha sido el uso de degradadores monovalentes, a menudo denominados pegamentos moleculares. Estos funcionan de manera similar a los PROTAC, pero modifican químicamente la superficie de la enzima o de la proteína objetivo para que ambas puedan unirse directamente. Estos compuestos superan las limitaciones de los PROTAC porque son más pequeños y siguen siendo eficaces en concentraciones más altas.
Un fármaco adhesivo molecular, descubierto tras un programa de investigación en el ICR, ya se encuentra en fase inicial de ensayos clínicos.
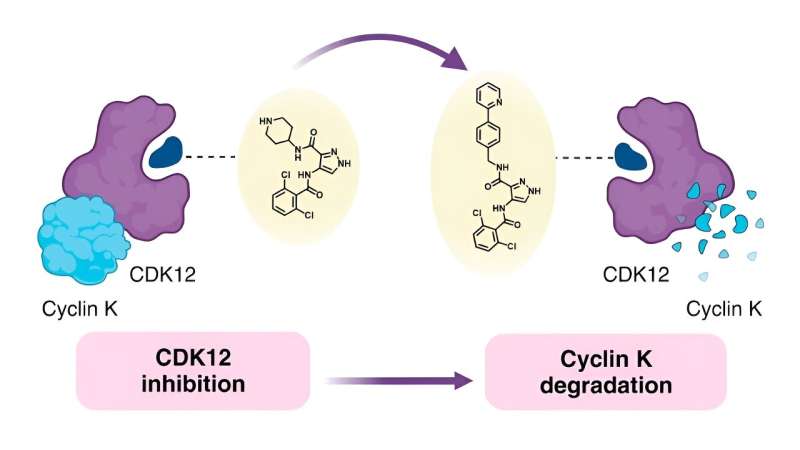
Queriendo comprender el vínculo entre la estructura química de los pegamentos moleculares y cómo se comportan, conocida como relación estructura-actividad (SAR), los investigadores detrás del estudio actual decidieron utilizar un degradador monovalente conocido llamado CR8 como punto de partida. CR8 inhibe todas las quinasas dependientes de ciclina (CDK), que desempeñan múltiples funciones en el desarrollo de tumores, pero también degrada la proteína ciclina K, que promueve las vías de señalización del cáncer.
Investigaciones anteriores han demostrado que CR8 se une a CDK12 y a un componente de la ligasa E3 llamado proteína de unión al ADN dañado 1 (DDB1). Esto permite que la célula descomponga la ciclina K unida a CDK12.
Armado con esta información, el equipo intentó sustituir la piridina de CR8 por una amplia gama de sustitutos. Primero intentaron utilizar grupos simples, incluidos flúor, metilo e hidroxi, antes de pasar a formaciones más complejas para determinar cómo estos cambios afectaban la capacidad de degradación.
En la segunda parte del estudio, los investigadores aplicaron su mayor conocimiento sobre el degradador SAR a otros inhibidores de CDK para determinar si sus hallazgos eran transferibles. Descubrieron que los componentes moleculares que inducían la degradación de proteínas podrían usarse para convertir múltiples inhibidores diferentes en degradadores. También identificaron ciertos sustitutos que condujeron a una mejor degradación.
La primera autora Katie Thomas, Ph.D. estudiante de la División de Terapéutica del Cáncer del ICR, dijo:"Fue sorprendente ver que se podría usar una gama tan amplia de grupos para inducir la degradación de la ciclina K. Esto significa que la interfaz de interacción entre CDK12 unido al degradador y DDB1 no "Es necesario optimizar perfectamente para que se produzca la degradación. Esto es prometedor para el futuro del uso de pegamentos monovalentes como modalidades terapéuticas:nos ayudará a hacer avanzar las moléculas desde el descubrimiento hasta la optimización".
Los inhibidores de la proteína quinasa se han utilizado en el tratamiento del cáncer durante más de dos décadas. Actúan bloqueando la acción de las proteínas quinasas, enzimas que controlan la función de las proteínas y que pueden provocar un crecimiento celular desregulado si mutan.
Aunque estos tratamientos pueden funcionar bien, existe el riesgo de que el cáncer se vuelva resistente a ellos. Esto se debe a que los inhibidores obstruyen las proteínas relacionadas con el cáncer en lugar de destruirlas, y las células tumorales a veces pueden reactivarlas.
Además, cuando algunos inhibidores bloquean algunas proteínas quinasas, la célula lo compensa utilizando otras quinasas para realizar las mismas acciones.
Deshacerse completamente de las proteínas mediante la degradación de las mismas elimina estos riesgos.
Este estudio sirve como punto de partida para otros investigadores que buscan diseñar pegamentos moleculares, identificar objetivos proteicos prometedores para la degradación y desarrollar nuevas moléculas que puedan funcionar como terapias degradantes.
Thomas dijo:"Tenemos la hipótesis de que otros inhibidores de moléculas pequeñas podrían convertirse en degradadores mediante la adición de ciertos grupos. Nuestro equipo actualmente está explorando si ciertos grupos pueden unirse a otros tipos de inhibidores de quinasa para convertirlos en degradadores monovalentes. El trabajo también es Se están realizando estudios para determinar si estos compuestos pueden degradar otras proteínas".
En teoría, una vez que los investigadores hayan adquirido una comprensión completa del SAR degradador, será posible eliminar una variedad de proteínas promotoras del cáncer en diferentes tipos de cáncer. Por lo tanto, este enfoque podría abrir la puerta a nuevos tratamientos eficaces contra el cáncer.
El autor correspondiente, el Dr. Benjamin Bellenie, científico senior de la División de Terapéutica del Cáncer del ICR, dijo:"Este estudio ha mejorado significativamente nuestra comprensión sobre el diseño de degradadores monovalentes. Nos hemos centrado específicamente en los degradadores de ciclina K y necesitamos trabajar si podemos replicar este enfoque para nuevos objetivos. Sin embargo, creemos que nuestra investigación podría permitir futuros descubrimientos de fármacos".
Más información: Katie L. Thomas et al, Degradación por diseño:nuevos degradadores de ciclina K a partir de antiguos inhibidores de CDK, ACS Chemical Biology (2024). DOI:10.1021/acschembio.3c00616
Información de la revista: Biología química del ACS
Proporcionado por el Instituto de Investigación del Cáncer