En el cuerpo humano, las moléculas conocidas como quinasas propagan señales dentro y entre las células, transmitiendo señales que permiten a las células responder a los cambios en el medio ambiente. Sin embargo, hay cientos de quinasas diferentes en el cuerpo e identificar sus funciones individuales y colectivas es un desafío.
En un nuevo estudio, el farmacólogo de Yale Benjamin Turk y sus colegas desarrollaron herramientas que pueden ayudar a los investigadores a concentrarse en las funciones de las quinasas individuales y comenzar a descubrir una imagen más completa de su contribución colectiva a la función biológica.
Y debido a que las quinasas disfuncionales a menudo están implicadas en el cáncer, una comprensión más refinada de su función puede generar mejores tratamientos en el futuro, afirman.
Los hallazgos fueron publicados en Nature. .
Las quinasas son enzimas que facilitan un proceso llamado fosforilación. En los casos que involucran proteínas, una proteína quinasa recluta una parte de una molécula llamada grupo fosfato (un fragmento molecular que consta de un átomo de fósforo y cuatro átomos de oxígeno) y ayuda a unirlo a un área específica de una proteína conocida como sitio de fosforilación. Esto puede cambiar la función de la proteína de varias maneras, alterando su actividad o hacia dónde viaja, por ejemplo.
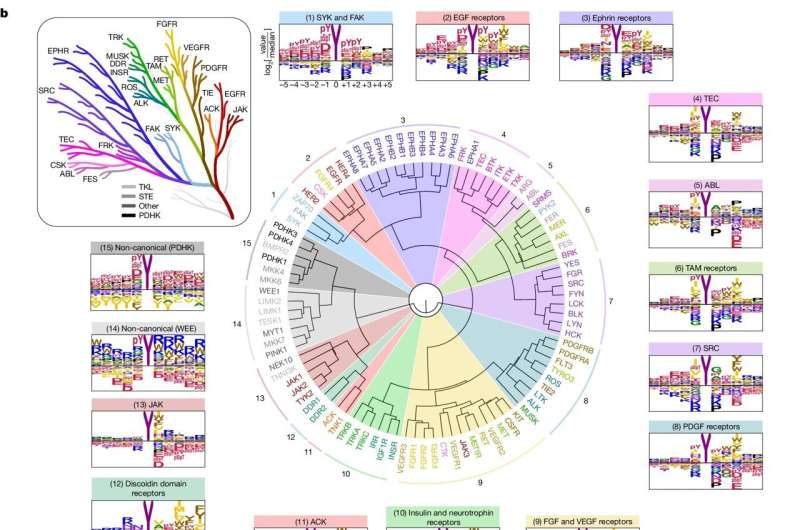
Hay dos tipos de proteínas quinasas dependiendo de las proteínas que fosforilan:serina/treonina quinasas, en las que Turk se centró en un estudio anterior, y tirosina quinasas, el tema del nuevo estudio.
"Las tirosina quinasas, en particular, son realmente importantes para la comunicación entre células y entre órganos", dijo Turk, profesor asociado de farmacología en la Facultad de Medicina de Yale. "La clase principal de tirosina quinasas está asociada con factores de crecimiento. Comprender cómo las tirosina quinasas envían señales es clave para comprender cómo las células se comunican entre sí, siendo esa comunicación a menudo una señal para crecer o dividirse".
Todos los tipos de tirosina quinasas (de las cuales hay 78 en humanos) tienden a enviar señales de crecimiento excesivas cuando se hiperactivan, lo cual es un evento clave en el crecimiento tumoral, dice Turk.
"Este tipo de estudio nos ayuda a comprender la organización de la señalización de la tirosina quinasa, lo que nos da una idea de cómo las quinasas envían señales de crecimiento y cómo el bloqueo de las quinasas podría conducir a una respuesta terapéutica", afirmó.
Para el estudio, los investigadores observaron primero cómo las quinasas reconocen sus objetivos. Las proteínas están formadas por aminoácidos, de los cuales hay 20; Las quinasas reconocen cadenas cortas de aminoácidos que rodean el sitio que fosforilan.
Específicamente, los investigadores distribuyeron cada una de las 78 tirosina quinasas en pocillos individuales de placas de laboratorio, las mezclaron con una gran cantidad de cadenas de aminoácidos diferentes y luego observaron qué cadenas preferían fosforilar las quinasas. Luego compararon las cadenas preferidas de las quinasas con las proteínas del cuerpo humano.
"Y aprendimos algunas cosas al hacer esto", dijo Turk.
En primer lugar, podrían, hasta cierto punto, comenzar a hacer coincidir las quinasas con sus objetivos en el cuerpo, lo que brinda a los investigadores información sobre el papel específico de una quinasa en particular.
Quizás lo más importante es que sus hallazgos les permitieron descubrir algunas de las reglas más amplias de la actividad de la tirosina quinasa. Fue como si comenzaran a ver el cableado de una casa en lugar de solo dónde estaban los enchufes individuales, dijo Turk.
Una de esas reglas tiene que ver con cómo las tirosina quinasas reclutan quinasas adicionales para propagar una cascada de señalización. Otro implica cómo los aminoácidos que rodean un sitio de fosforilación dictan no sólo dónde ocurrirá la fosforilación sino también la velocidad a la que ocurre.
Y, algo importante para el desarrollo del tratamiento, las herramientas desarrolladas en este estudio permiten a los investigadores inferir qué quinasas podrían estar activas en una célula o tejido en un momento particular y cómo perturbarlas podría afectar su función.
"Podemos usar medicamentos para inhibir las quinasas individuales y, cuando lo hacemos, podemos ver cómo disminuye la actividad de esa quinasa", dijo Turk. "Y los inhibidores de la tirosina quinasa son uno de los principales tratamientos dirigidos contra el cáncer. Pero las células cancerosas pueden adaptarse a ese tipo de terapia y volverse resistentes a ella, lo que provoca que los pacientes recaigan".
Con sus herramientas, los investigadores pueden observar cómo el bloqueo de una quinasa con un inhibidor a veces conduce a que otras quinasas se sobreactiven, lo que puede explicar cómo las células cancerosas se adaptan y continúan creciendo. Y eso puede ayudar a los investigadores a desarrollar terapias más efectivas, afirmó Turk.
En el futuro, Turk pretende utilizar las reglas descubiertas en este trabajo para comenzar a desentrañar procesos biológicos clave y analizar más a fondo cómo responden diferentes células a diversos inhibidores de quinasa.
Pero hay otra conclusión clave de este trabajo para él.
Las tirosina quinasas son más nuevas, evolutivamente hablando, que otras quinasas y surgieron en organismos multicelulares. Cuando Turk y sus colegas compararon las tirosina quinasas humanas con las de los nematodos (un tipo de gusano del que se separó la rama humana del árbol evolutivo hace millones de años), la especificidad de ambos grupos de quinasas, o cuán particulares son acerca de sus objetivos, eran extremadamente similares.
"Eso dice que esta especificidad, y comprender cómo ocurre, realmente importa", dijo Turk. "Se ha conservado a lo largo de millones de años de evolución, y la naturaleza no lo habría mantenido con tanto detalle sin razón."
Más información: Lewis Cantley, La especificidad de sustrato intrínseca del kinoma de tirosina humana, Naturaleza (2024). DOI:10.1038/s41586-024-07407-y. www.nature.com/articles/s41586-024-07407-y
Información de la revista: Naturaleza
Proporcionado por la Universidad de Yale