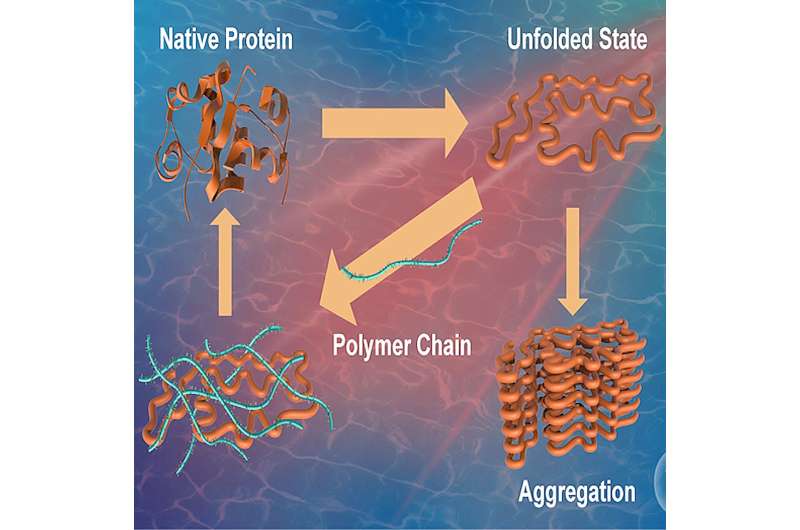
Las proteínas son biomoléculas vitales responsables de realizar diversas funciones en el cuerpo humano y, por lo tanto, se las considera los caballos de batalla de una célula. La estructura primaria de una proteína está compuesta por la unión de diferentes aminoácidos. La estructura así formada sufre luego el plegamiento de la proteína, un proceso mediante el cual una proteína adquiere su configuración tridimensional característica y funcional.
Este estado, denominado "estado nativo", es crucial para el funcionamiento adecuado de las proteínas. Las condiciones desfavorables, como el estrés o la exposición a agentes externos, pueden provocar que las proteínas se pleguen mal y formen agregados, dificultando su capacidad para realizar sus funciones originales.
Se ha implicado que el plegamiento incorrecto de las proteínas es la causa subyacente de una variedad de enfermedades humanas, en particular el Alzheimer, el Huntington y el Parkinson. Además, también se sabe que la formación de agregados afecta la eficacia y seguridad de los fármacos a base de proteínas. Esto subraya la necesidad de investigar compuestos y estrategias que puedan suprimir el plegamiento incorrecto y mejorar la estabilización de las proteínas.
Estudios recientes han informado sobre la capacidad de estabilización de proteínas de algunos polímeros. Sin embargo, su mecanismo de acción y el impacto de las interacciones entre los componentes hidrofóbicos (los componentes que repelen el agua) y las proteínas no se comprenden bien.
Para abordar esta brecha de conocimiento, un equipo de investigadores dirigido por el profesor Kazuaki Matsumura del Instituto Avanzado de Ciencia y Tecnología de Japón (JAIST), incluido el ex profesor asistente Robin Rajan, el investigador doctoral Dr. Dandan Zhao de JAIST y el profesor asistente Tadaomi Furuta. del Instituto de Tecnología de Tokio, realizó un estudio para dilucidar el mecanismo de inhibición de la agregación de proteínas por la sulfobetaína (SPB).
En su estudio publicado en Cell Reports Physical Science , los investigadores también intentaron comprender las interacciones específicas que ocurren entre los componentes hidrofóbicos y las proteínas y su impacto en la agregación de proteínas.

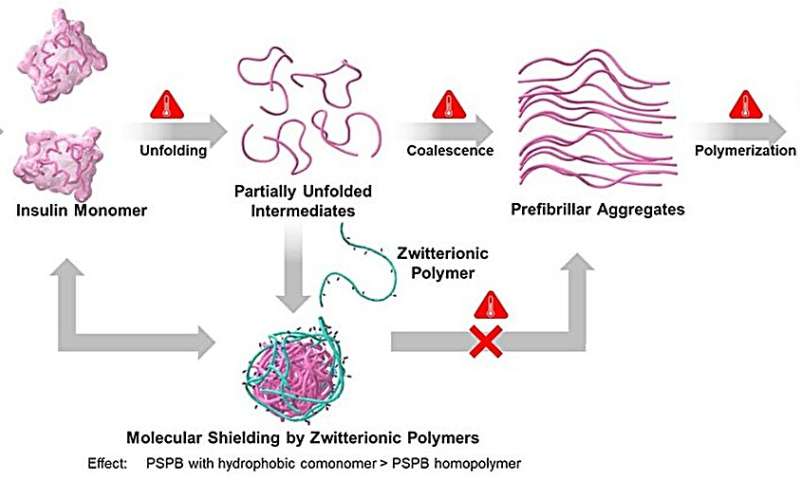
Al explicar el fundamento de este estudio, el profesor Matsumura dice:"Anteriormente, realizamos un estudio sobre polisulfobetaínas (PSPB), un polímero zwitteriónico que consta de grupos funcionales con cargas positivas y negativas. Descubrimos que el polímero mostraba una eficiencia excepcional en la supresión agregación de proteínas, sin embargo, el impacto de la hidrofobicidad permaneció inexplorado."
En este estudio, los investigadores sintetizaron PSPB con diferentes pesos moleculares y agregaron cantidades variables de monómeros hidrófobos individualmente y con diferentes cadenas alquílicas mediante un proceso conocido como polimerización por transferencia de cadena por adición-fragmentación reversible. Luego, los investigadores analizaron las propiedades estabilizadoras de proteínas de estos polímeros y examinaron las interacciones entre polímeros y proteínas mediante técnicas fisicoquímicas.
Sus hallazgos revelaron que los PSPB ofrecían estabilización de proteínas al alterar las vías importantes implicadas en la agregación de proteínas. Además, la hidrofobicidad y el peso molecular influyeron en la prevención de la agregación de proteínas y en la mejora de la estabilización de las proteínas. El aumento de estos factores amplificó las interacciones débiles y reversibles entre SPB y las proteínas.
"Podemos considerar estos polímeros como escudos moleculares reversibles que alteran la vía de agregación", explica el profesor Matsumura al comentar los resultados de su estudio. Los investigadores también descubrieron que al eliminar el estrés, se observaba un replegamiento de los intermedios parcialmente desplegados, lo que sugiere la recuperación de sus estados nativos.
Por lo tanto, al desentrañar los intrincados mecanismos moleculares de la supresión de la agregación de proteínas mediante polímeros zwitteriónicos, este estudio pionero puede abrir vías para nuevas estrategias terapéuticas que retrasen o prevengan enfermedades y ayuden a garantizar la seguridad de los medicamentos basados en proteínas.
En palabras del Prof. Matsumura, "En 5 a 10 años, esta investigación podría conducir al desarrollo de tratamientos novedosos y más efectivos para afecciones relacionadas con el plegamiento incorrecto de las proteínas, mejorando significativamente los resultados de los pacientes. Además, puede permitir la producción de proteínas más estables. y terapias proteicas rentables, que benefician a la industria farmacéutica y a los proveedores de atención médica".
Más información: Mecanismo molecular de inhibición de la agregación de proteínas con polímeros de sulfobetaína y sus derivados hidrofóbicos, Cell Reports Physical Science (2024). DOI:10.1016/j.xcrp.2024.102012. www.cell.com/cell-reports-phys... 2666-3864(24)00280-7
Información de la revista: Informes celulares de ciencias físicas
Proporcionado por el Instituto Avanzado de Ciencia y Tecnología de Japón