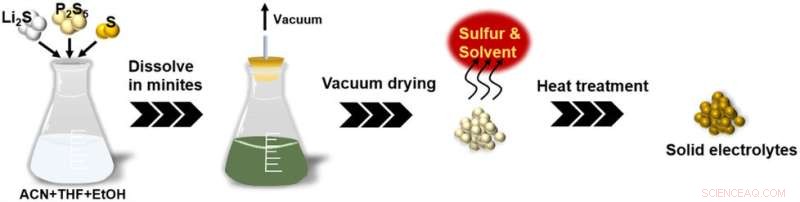
Esquemas de la nueva tecnología de procesamiento de soluciones para SE de sulfuro. Crédito:Universidad Tecnológica de Toyohashi
Un grupo de investigación en el programa de doctorado del Departamento de Ingeniería de Información Eléctrica y Electrónica de la Universidad Tecnológica de Toyohashi que incluye al estudiante de doctorado Hirotada Gamo y al profesor asistente especialmente designado Jin Nishida, al profesor asociado especialmente designado Atsushi Nagai, al profesor asistente Kazuhiro Hikima, al profesor Atsunori Matsuda y otros, desarrollaron una tecnología de fabricación a gran escala de Li7 P3 S11 electrolitos sólidos para baterías secundarias de iones de litio de estado sólido.
Este método implica la adición de una cantidad excesiva de azufre (S) junto con Li2 S y P2 S5 , los materiales de partida de Li7 P3 S11 , a un disolvente que contiene una mezcla de acetonitrilo (ACN), tetrahidrofurano (THF) y una pequeña cantidad de etanol (EtOH). Esto ayudó a acortar el tiempo de reacción de 24 horas o más a solo dos minutos. El producto final obtenido con este método es Li7 de alta pureza. P3 S11 sin una fase de impurezas que mostró una alta conductividad iónica de 1,2 mS cm -1 a 25 °C. Estos resultados nos permiten producir una gran cantidad de electrolitos sólidos de sulfuro para baterías de estado sólido a bajo costo. Los resultados de la investigación fueron publicados en línea por Advanced Energy and Sustainability Research el 28 de abril de 2022.
Detalles
Se espera que las baterías de estado sólido sean la próxima generación de baterías para vehículos eléctricos (EV) porque son muy seguras y permiten una transición a una alta densidad de energía y una alta potencia de salida. Los electrolitos sólidos de sulfuro, que muestran buena conductividad iónica y plasticidad, se han desarrollado activamente con miras a las aplicaciones para baterías de estado sólido en vehículos eléctricos. Sin embargo, no se ha establecido una tecnología de fabricación a gran escala de electrolitos sólidos de sulfuro a nivel de comercialización, ya que los electrolitos sólidos de sulfuro son inestables en la atmósfera y el proceso para sintetizarlos y procesarlos requiere control atmosférico. Por esta razón, existe una necesidad urgente de desarrollar la tecnología de fabricación en fase líquida de electrolitos sólidos de sulfuro que ofrezca bajo costo y alta escalabilidad.
Li7 P3 S11 Los electrolitos sólidos exhiben una alta conductividad iónica y, por lo tanto, son un electrolito sólido candidato para baterías de estado sólido. La síntesis en fase líquida de Li7 P3 S11 generalmente ocurre en un solvente de reacción de acetonitrilo (ACN) a través de precursores que incluyen compuestos insolubles. Los procesos de reacción convencionales como este toman mucho tiempo ya que pasan por una reacción cinéticamente desventajosa desde un material de partida insoluble a un intermedio insoluble. Peor aún, es posible que el intermedio insoluble cree falta de uniformidad a través de una formación de fase complicada, lo que lleva a un aumento en los costos de fabricación a gran escala.
En este contexto, el grupo de investigación trabajó en el desarrollo de una tecnología para la producción en fase líquida de Li7 altamente conductor de iones. P3 S11 electrolitos sólidos a través de soluciones precursoras uniformes. Se ha demostrado que el método desarrollado recientemente puede obtener una solución precursora uniforme que contiene polisulfuro de litio soluble (Li2 Sx ) en solo dos minutos, agregando Li2 S y P2 S5 , los materiales de partida de Li7 P3 S11 , y una cantidad excesiva de S a un disolvente que contiene una mezcla de ACN, THF y una pequeña cantidad de EtOH. La clave para la síntesis rápida en este método es la formación de polisulfuro de litio mediante la adición de una pequeña cantidad de EtOH o una cantidad excesiva de S.
Para dilucidar el mecanismo de la reacción en este método, se utilizó espectroscopia ultravioleta-visible (UV-Vis) para investigar la estabilidad química de Li2 Sx con y sin el EtOH añadido. El estudio mostró que la presencia de EtOH hizo Li2 Sx más químicamente estable. Por lo tanto, la reacción en este método tomaría los siguientes pasos. Primero, los iones de litio están fuertemente coordinados con EtOH, un solvente altamente polar. A continuación, proteger los iones de polisulfuro contra los iones de litio estabiliza el S3 altamente reactivo ・ - radical anions which are a kind of polysulfide. The generated S3 ・ - attacks the P2 S5, breaking the cage structure of P2 S5 and causing the reaction to progress. The reaction forms lithium thiophosphate which dissolves into a highly soluble mixed solvent containing ACN and THF solvents. This may have helped to obtain uniform precursor solutions very rapidly. The final product, Li7 P3 S11 , could be prepared in two hours without the necessity of ball milling or high energy treatment in the process of reaction.
The ion conductivity of the Li7 P3 S11 obtained using this method was 1.2 mS cm -1 at 25 °C, higher than the Li7 P3 S11 synthesized using the conventional liquid-phase synthesis method (0.8 mS cm -1 ) or ball milling (1.0 mS cm -1 ). The method proposes a new path for the synthesis of a sulfide solid electrolyte and achieves a large-scale manufacturing technology with low cost.
Future Outlook
The research team believes that the low-cost technology for the large-scale manufacturing of sulfide solid electrolytes for all-solid-state batteries proposed in this research could be important in the commercialization of EVs equipped with all-solid-state batteries. The research focused on Li7 P3 S11 for use as a sulfide solid electrolyte. We also want to apply this technology to the synthesis of sulfide solid electrolytes other than Li7 P3 S11 . Solvent effect on liquid-phase synthesis of lithium solid electrolytes