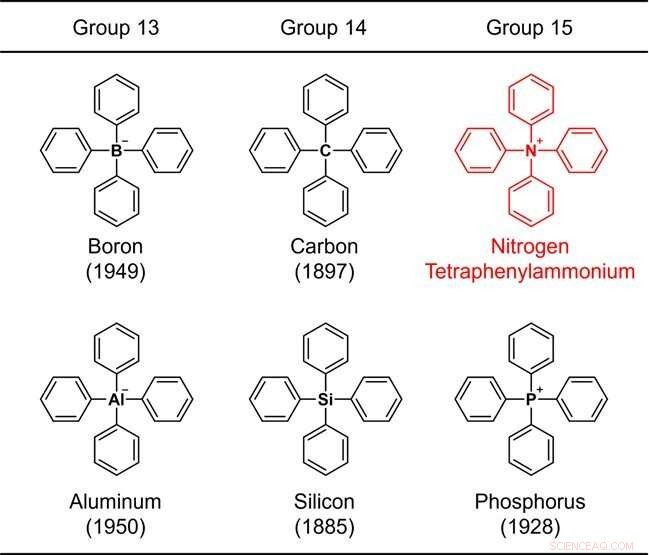
Figura 1. Estructuras de elementos sustituidos con tetrafenilo pertenecientes a los grupos 13–15. El número entre paréntesis indica el año de síntesis. Crédito:Universidad de Kanazawa
Tetrafenilamonio, con los cuatro hidrógenos del amonio (NH4 + ) reemplazado con anillos de benceno, no se ha descubierto en la naturaleza ni se ha sintetizado químicamente, lo que pone en duda su existencia. Aquí logramos sintetizar tetrafenilamonio por primera vez, demostrando su existencia estable. La estrategia de síntesis utilizada en este estudio, el acoplamiento radical, puede ser aplicable a la síntesis de varios amonios relacionados con una gran novedad estructural. El estudio se publica en Nature Communications .
Dado que el anillo de benceno es un componente representativo de los compuestos orgánicos, una estructura que consta solo de un elemento común más el anillo de benceno se considera uno de los esqueletos químicos más fundamentales. Debido a su importancia, la síntesis química de tales moléculas se ha estudiado desde los primeros días de la química orgánica. Por ejemplo, la estructura en la que cuatro anillos de benceno se unen a un elemento representativo (boro, carbono, aluminio, silicio o fósforo) de los grupos 13 a 15 de la tabla periódica (Fig. 1) se sintetizó hace más de 70 años, y el informe sintético más antiguo data de 137 años.
Estos esqueletos se conocen colectivamente como "tetrafenilo", lo que significa que la estructura contiene 4 anillos de benceno. Cuando el elemento central es nitrógeno, amonio, NH4 + , se considera como el ion padre. Tal compuesto se llama tetrafenilamonio. Este compuesto, de hecho un ion, tiene una estructura química muy simple que incluso un principiante en química orgánica puede imaginar fácilmente.
Sin embargo, ha resultado muy difícil crear artificialmente esta estructura y no se han publicado informes sintéticos con una clara identificación de la estructura. Además, dado que no se ha descubierto en la naturaleza, hasta ahora no estaba claro si el tetrafenilamonio puede existir. Han aparecido publicaciones que dan por supuesta su existencia y mencionan únicamente su uso sin describir su síntesis o método de adquisición. Las bases de datos compuestas contienen solo la estructura química. Por lo tanto, a veces se hace referencia a este ion como si ya se conociera. Sin embargo, en realidad, nadie lo ha observado, por lo que el tetrafenilamonio es un "ion fantasma".
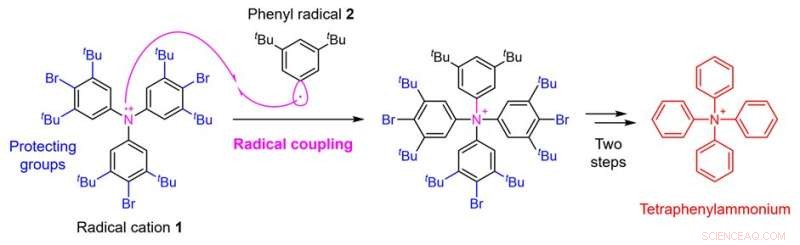
Figura 2. Estrategia de síntesis de tetrafenilamonio mediante acoplamiento de radicales. Crédito:Universidad de Kanazawa
En este estudio, un equipo de investigación de la Facultad de Ciencias Farmacéuticas de la Universidad de Kanazawa ha permitido la síntesis de tetrafenilamonio mediante el establecimiento de una nueva estrategia sintética. El punto crítico en la síntesis de tetrafenilamonio es la adición del cuarto grupo fenilo al átomo de nitrógeno que ya tiene tres grupos fenilo unidos. Se pensó que sería difícil lograr esta síntesis con técnicas convencionales. En el presente estudio, por lo tanto, el equipo de investigación aplicó una técnica llamada acoplamiento de radicales y utilizó una estrategia de reacción del catión radical 1 preparado a partir de un derivado de trifenilamina con el radical fenilo 2 (Fig. 2).
Como resultado, aunque el rendimiento fue tan bajo como 0,1 %, el equipo de investigación logró realizar la conversión química deseada. En tales acoplamientos de radicales, los radicales altamente reactivos forman enlaces entre sí, lo que tiene la ventaja de permitir la formación de enlaces que no podrían lograrse con otros métodos. Por otro lado, tiene la desventaja de que es difícil controlar la selectividad porque la reactividad es demasiado alta, lo que da lugar a diversas reacciones secundarias.
Por tanto, en esta síntesis, para suprimir en la medida de lo posible la reacción secundaria de formación de enlaces en el carbono del radical catión 1, el equipo de investigación ideó también la introducción de grupos protectores que provocan impedimento estérico. Finalmente, se llevaron a cabo un total de cinco pasos de conversión química de un derivado de trifenilamina conocido, el material de partida para la síntesis, a través de la introducción de los grupos protectores, el acoplamiento de radicales y la posterior eliminación de los grupos protectores, dando lugar al tetrafenilamonio.

Figura 3. Estructura cristalina de rayos X del tetrafenilamonio. Crédito:Universidad de Kanazawa
Sobre la base de los datos obtenidos de varios análisis instrumentales, se confirmó la estructura del tetrafenilamonio. cristalografía de rayos X) reveló que la longitud del enlace entre el átomo de nitrógeno y el átomo de carbono del grupo fenilo contenido en este ion es de solo 1,529 Å (Fig. 3).
Dado que la longitud de este enlace es más corta que la de una estructura de tetrafenilo que contiene otro elemento (boro, carbono, aluminio, silicio o fósforo), es evidente que el átomo de nitrógeno del tetrafenilamonio se encuentra en un entorno con más obstáculos espaciales que otros elementos. Este obstáculo tridimensional se considera uno de los factores que dificultan la construcción de este esqueleto. Además, nuestros resultados también revelaron que el tetrafenilamonio tiene una alta estabilidad para soportar condiciones fuertemente ácidas y básicas.
El presente estudio ha demostrado que el tetrafenilamonio existe y puede sintetizarse químicamente. Si la síntesis a gran escala de este ion y sus derivados se realiza en el futuro, podría aplicarse potencialmente en varios campos de investigación como un catión orgánico con alta estabilidad química. Además, la estrategia de acoplamiento de radicales utilizada en este estudio puede ser aplicable a la síntesis de otros amonios relacionados que no se han podido realizar hasta el momento. Formación de radicales arilo por ruptura de enlaces de haluro de arilo por un catalizador de carbeno N-heterocíclico