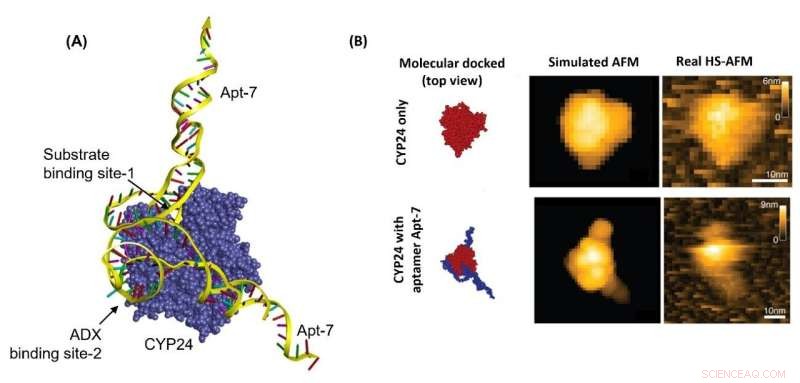
Figura 1. Un enfoque integrado de HS-AFM y acoplamiento molecular para revelar el mecanismo de unión de Apt-7 a CYP24 (A) La vista tridimensional de las conformaciones acopladas de alto rango de CYP24 y Apt-7. Los sitios de unión predichos de Apt-7 se muestran con una flecha. El aptámero se une al sitio de unión del sustrato de CYP24 (sitio de unión-1) y al sitio de unión de ADX de CYP24 (sitio de unión-2). (B) Comparación de los gráficos de pseudo-HS-AFM de CYP24-Apt-7 utilizando la pose de mayor clasificación generada por acoplamiento molecular del complejo CYP24-Apt-7 con las imágenes en tiempo real capturadas por HS-AFM. Crédito:Universidad de Kanazawa
Investigadores de la Universidad de Kanazawa en colaboración con equipos de la Universidad de la Prefectura de Toyama y BioSeeds Corporation informan en ACS Applied Materials &Interfaces la identificación de una molécula con actividad antiproliferativa potenciada en células cancerosas. El mecanismo biomolecular subyacente es la inhibición de una enzima que se produce en exceso en varios tipos de cáncer.
La vitamina D3 tiene funciones biológicas importantes, incluido el mantenimiento de la densidad mineral ósea, lo que minimiza el riesgo de fractura ósea. Pero también se cree que la vitamina D3 tiene actividad anticancerígena, ya que los niveles bajos de vitamina D3 y la sobreproducción asociada de una enzima llamada CYP24 están relacionados con un mal pronóstico para los pacientes con cáncer. Las moléculas que limitan o inhiben la acción de CYP24 y las moléculas que imitan la función de la vitamina D3 son actualmente muy investigadas como posibles agentes antiproliferativos para el tratamiento del cáncer.
Sin embargo, muchos de los inhibidores y análogos de D3 sintetizados hasta el momento han mostrado una respuesta clínica insuficiente, así como efectos secundarios no deseados. Ahora, Madhu Biyani de la Universidad de Kanazawa y sus colegas han identificado una molécula derivada de ADN que se une e inhibe la función de CYP24 y muestra una actividad antiproliferativa prometedora. El equipo de investigación también brinda información detallada sobre los procesos moleculares relevantes en juego.
Los científicos seleccionaron una gran cantidad de aptámeros de ADN:fragmentos de ADN monocatenario con estructuras tridimensionales particulares que pueden unirse a moléculas diana específicas y tener un efecto funcional sobre la unión. Buscaron aptámeros de ADN que se unieran a CYP24 pero no a la enzima similar CYP271B, que es responsable de la síntesis de vitamina D3.
Una larga lista inicial de 18 candidatos a aptámeros se redujo a 11 representantes con estructuras moleculares específicas. Los investigadores comprobaron la actividad de inhibición de CYP24 de los 11 aptámeros representativos in vitro. Quedaron cuatro candidatos que resultaron en la inhibición de CYP24 pero no en la inhibición de CYP27B1, de los cuales uno (Apt-7) se retuvo para estudios adicionales.
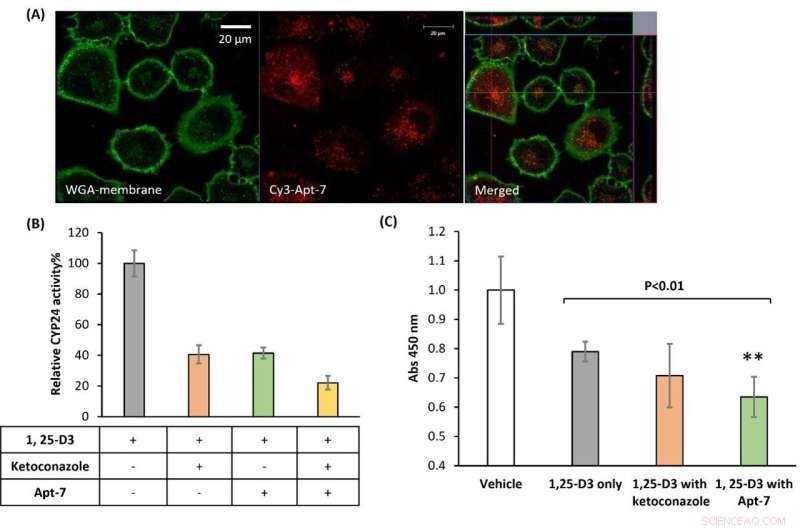
Figura 2. La internalización del aptámero en células A549 es indispensable para la inhibición de CYP24 y la mejora de la inhibición del crecimiento celular mediada por 1, 25-D3. (A) Internalización de aptámero en células A549. Se trataron células de cáncer de pulmón A549 con aptámero Apt-7 500 nM y se tiñeron sus membranas de verde (conjugados de aglutinina de germen de trigo (WGA)). La microscopía confocal reveló la señal intracelular, derivada del aptámero internalizado (fluorescencia roja, Cy3). (B) Apt-7 inhibe el catabolismo mediado por CYP24 de 1,25-D3 en células A549. Después de 18 h de tratamiento con aptámero, se determinó por HPLC la relación de conversión del metabolito 1, 25-D3 y la actividad relativa de CYP24. (C) Apt-7 mejora la función antiproliferativa de 1, 25-D3 en células A549. Crédito:Universidad de Kanazawa
Biyani y sus colegas realizaron simulaciones de la unión de Apt-7 a CYP24. Se obtuvo un escenario de acoplamiento molecular, que comprobaron experimentalmente comparando el comportamiento de una mezcla de vitamina D3 y CYP24 con y sin Apt-7. Las simulaciones y los experimentos mostraron que Apt-7 da como resultado la inhibición de la actividad de CYP24, y lo que sucede es que el aptámero probablemente interfiere con el sitio activo de la enzima. Los investigadores también realizaron microscopía de fuerza atómica de alta velocidad en la unión de CYP24 y Apt-7 en tiempo real, lo que confirmó el escenario de acoplamiento molecular obtenido de las simulaciones.
Finalmente, el equipo de investigación estudió el efecto de Apt-7 a nivel celular al introducir la molécula en las células cancerosas. Observaron una inhibición significativa de CYP24 para una línea celular de cáncer conocida por sobreexpresar la enzima CYP24, mostrando así actividad antiproliferativa. Citando a Biyani y sus colegas, estos hallazgos "caracterizaron claramente y propusieron que una molécula basada en aptámeros de ADN podría ser un candidato principal prometedor para la terapia contra el cáncer". Los científicos desarrollan un modelo computacional novedoso para la generación de aptámeros, con amplias aplicaciones