
Crédito:Valerie Altounian
Independientemente de lo que esté haciendo, ya sea conducir un automóvil, salir a correr o incluso en su momento más perezoso, comer papas fritas y mirar televisión en el sofá, hay un conjunto completo de maquinaria molecular dentro de cada una de sus células trabajando duro. Esa maquinaria, demasiado pequeña para verla a simple vista o incluso con muchos microscopios, crea energía para la célula, fabrica sus proteínas, hace copias de su ADN y mucho más.
Entre esas piezas de maquinaria, y una de las más complejas, se encuentra algo conocido como el complejo de poros nucleares (NPC). El NPC, que está hecho de más de 1,000 proteínas individuales, es un guardián increíblemente discriminatorio para el núcleo de la célula, la región unida a la membrana dentro de una célula que contiene el material genético de esa célula. Cualquier cosa que entre o salga del núcleo tiene que pasar por el NPC en su camino.
El papel del NPC como guardián del núcleo significa que es vital para las operaciones de la célula. Dentro del núcleo, el ADN, el código genético permanente de la célula, se copia en ARN. Luego, ese ARN se extrae del núcleo para que pueda usarse para fabricar las proteínas que necesita la célula. El NPC se asegura de que el núcleo obtenga los materiales que necesita para sintetizar el ARN, al mismo tiempo que protege el ADN del entorno hostil fuera del núcleo y permite que el ARN abandone el núcleo después de que se haya producido.
"Es un poco como un hangar de aviones donde puedes reparar 747, y la puerta se abre para permitir que entre el 747, pero hay una persona parada allí que puede evitar que salga una sola canica mientras las puertas están abiertas", dice André de Caltech. Hoelz, profesor de química y bioquímica y becario de la facultad del Instituto Médico Howard Hughes. Durante más de dos décadas, Hoelz ha estado estudiando y descifrando la estructura del NPC en relación con su función. A lo largo de los años, ha descifrado constantemente sus secretos, desentrañándolos pieza por pieza.
Las implicaciones de esta investigación son potencialmente enormes. El NPC no solo es fundamental para las operaciones de la célula, sino que también está involucrado en muchas enfermedades. Las mutaciones en el NPC son responsables de algunos cánceres incurables, de enfermedades neurodegenerativas y autoinmunes como la esclerosis lateral amiotrófica (ELA) y la encefalopatía necrosante aguda, y de afecciones cardíacas que incluyen fibrilación auricular y muerte cardíaca súbita temprana. Además, muchos virus, incluido el responsable de COVID-19, apuntan y cierran el NPC durante el transcurso de sus ciclos de vida.
Ahora, en un par de artículos publicados en la revista Science , Hoelz y su equipo de investigación describen dos avances importantes:la determinación de la estructura de la cara exterior del NPC y la aclaración del mecanismo por el cual las proteínas especiales actúan como un pegamento molecular para mantener unido al NPC.
Un diminuto rompecabezas en 3D
En su artículo titulado "Arquitectura de la cara citoplasmática del poro nuclear", Hoelz y su equipo de investigación describen cómo mapearon la estructura del lado del NPC que mira hacia afuera desde el núcleo y hacia el citoplasma de las células. Para hacer esto, tuvieron que resolver el equivalente a un diminuto rompecabezas en 3D, utilizando técnicas de imagen como microscopía electrónica y cristalografía de rayos X en cada pieza del rompecabezas.
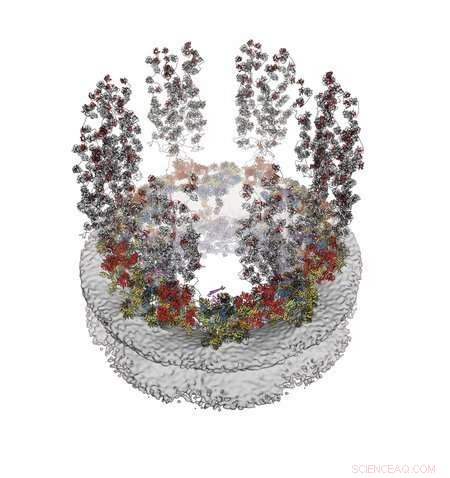
Un modelo molecular de la cara exterior (citoplasmática) del complejo del poro nuclear. Reimpreso con permiso de C.J. Bley et al., Science 376, eabm9129 (2022). Crédito:Laboratorio Hoelz/Caltech
Stefan Petrovic, estudiante graduado en bioquímica y biofísica molecular y uno de los primeros coautores de los artículos, dice que el proceso comenzó con la bacteria Escherichia coli (una cepa de bacteria comúnmente utilizada en los laboratorios) que fue modificada genéticamente para producir las proteínas que conforman el NPC humano.
"Si entras en el laboratorio, puedes ver esta pared gigante de matraces en los que crecen cultivos", dice Petrovic. "Expresamos cada proteína individual en las células de E. coli, las abrimos y purificamos químicamente cada componente de la proteína".
Una vez que se completó la purificación, que puede requerir hasta 1500 litros de cultivo bacteriano para obtener suficiente material para un solo experimento, el equipo de investigación comenzó a probar minuciosamente cómo encajaban las piezas del NPC.
George Mobbs, investigador asociado postdoctoral sénior en química y otro coautor principal del artículo, dice que la asamblea se realizó de manera "paso a paso"; en lugar de verter todas las proteínas juntas en un tubo de ensayo al mismo tiempo, los investigadores probaron pares de proteínas para ver cuáles encajaban, como dos piezas de un rompecabezas. Si se encontraba un par que encajaba, los investigadores entonces probaban las dos proteínas ahora combinadas contra una tercera proteína hasta que encontraban una que encajaba con ese par, y luego la estructura de tres piezas resultante se probaba contra otras proteínas, y así en. Abriéndose camino a través de las proteínas de esta manera, finalmente se produjo el resultado final de su artículo:una cuña de 16 proteínas que se repite ocho veces, como rebanadas de pizza, para formar la cara del NPC.
"Informamos la primera estructura completa de la cara citoplásmica completa del NPC humano, junto con una validación rigurosa, en lugar de informar una serie de avances incrementales de fragmentos o porciones basados en una observación parcial, incompleta o de baja resolución", dice Si Nie. , investigador asociado postdoctoral en química y también coautor del artículo. "Decidimos esperar pacientemente hasta que hubiéramos adquirido todos los datos necesarios, reportando una enorme cantidad de información nueva".
Su trabajo complementó la investigación realizada por Martin Beck del Instituto Max Planck de Biofísica en Frankfurt, Alemania, cuyo equipo usó tomografía crioelectrónica para generar un mapa que proporcionó los contornos de un rompecabezas en el que los investigadores tuvieron que colocar las piezas. Para acelerar la finalización del rompecabezas de la estructura del NPC humano, Hoelz y Beck intercambiaron datos hace más de dos años y luego construyeron estructuras independientes de todo el NPC. "El mapa de Beck, sustancialmente mejorado, mostraba mucho más claramente dónde debía colocarse cada pieza del NPC, para el cual determinamos las estructuras atómicas, similar a un marco de madera que define el borde de un rompecabezas", dice Hoelz.
Las estructuras determinadas experimentalmente de las piezas NPC del grupo Hoelz sirvieron para validar el modelado del grupo Beck. "Colocamos las estructuras en el mapa de forma independiente, usando diferentes enfoques, pero los resultados finales coincidieron completamente. Fue muy satisfactorio ver eso", dice Petrovic.
"Construimos un marco en el que ahora se pueden realizar muchos experimentos", dice Christopher Bley, investigador asociado postdoctoral senior en química y también coautor principal. "Tenemos esta estructura compuesta ahora, y permite e informa experimentos futuros sobre la función de NPC, o incluso enfermedades. Hay muchas mutaciones en el NPC que están asociadas con enfermedades terribles, y saber dónde están en la estructura y cómo se unirse puede ayudar a diseñar el próximo conjunto de experimentos para tratar de responder a las preguntas de qué están haciendo estas mutaciones".
'Este elegante arreglo de espaguetis'
En el otro artículo, titulado "Arquitectura del andamio enlazador en el poro nuclear", el equipo de investigación describe cómo determinó la estructura completa de lo que se conoce como andamio enlazador del NPC:la colección de proteínas que ayudan a mantener unido al NPC. al mismo tiempo que le proporciona la flexibilidad que necesita para abrirse y cerrarse y ajustarse para adaptarse a las moléculas que pasan.
Hoelz compara al NPC con algo construido con ladrillos de Lego que encajan entre sí sin bloquearse y, en cambio, están unidos por bandas elásticas que los mantienen mayormente en su lugar y les permiten moverse un poco.
"Llamo a estas piezas de pegamento sin estructura la 'materia oscura del poro'", dice Hoelz. "Este elegante arreglo de fideos espagueti mantiene todo unido".
El proceso para caracterizar la estructura del andamio enlazador fue muy similar al proceso utilizado para caracterizar las otras partes del NPC. El equipo fabricó y purificó grandes cantidades de los muchos tipos de proteínas enlazadoras y andamios, utilizó una variedad de experimentos bioquímicos y técnicas de imagen para examinar las interacciones individuales y las probó pieza por pieza para ver cómo encajaban en el NPC intacto.
Para verificar su trabajo, introdujeron mutaciones en los genes que codifican cada una de esas proteínas enlazadoras en una célula viva. Dado que sabían cómo esas mutaciones cambiarían las propiedades químicas y la forma de una proteína enlazadora específica, haciéndola defectuosa, podían predecir qué sucedería con la estructura de los NPC de la célula cuando se introdujeran esas proteínas defectuosas. Si los NPC de la célula eran funcional y estructuralmente defectuosos de la manera esperada, sabían que tenían la disposición correcta de las proteínas conectoras.
"Una célula es mucho más complicada que el sistema simple que creamos en un tubo de ensayo, por lo que es necesario verificar que los resultados obtenidos de los experimentos in vitro se mantengan in vivo", dice Petrovic.
El montaje de la cara exterior del NPC también ayudó a resolver un antiguo misterio sobre la envoltura nuclear, el sistema de doble membrana que rodea el núcleo. Al igual que la membrana de la célula dentro de la cual reside el núcleo, la membrana nuclear no es perfectamente lisa. Más bien, está repleto de moléculas llamadas proteínas integrales de membrana (IMP) que sirven en una variedad de funciones, incluida la de actuar como receptores y ayudar a catalizar reacciones bioquímicas.
Aunque los IMP se pueden encontrar tanto en el lado interior como en el exterior de la envoltura nuclear, no estaba claro cómo viajaban realmente de un lado al otro. De hecho, debido a que los IMP están atrapados dentro de la membrana, no pueden simplemente deslizarse a través del canal de transporte central del NPC como lo hacen las moléculas que flotan libremente.
Una vez que el equipo de Hoelz entendió la estructura del andamio enlazador del NPC, se dieron cuenta de que permite la formación de pequeños "canalones" alrededor de su borde exterior que permiten que los IMP se deslicen más allá del NPC de un lado de la envoltura nuclear al otro mientras quedando siempre incrustado en la propia membrana.
"Explica muchas cosas que han sido enigmáticas en el campo. Estoy muy feliz de ver que el canal de transporte central tiene la capacidad de dilatarse y formar puertas laterales para estos IMP, como habíamos propuesto originalmente hace más de una década. ", dice Hoelz.
En conjunto, los hallazgos de los dos artículos representan un avance en la comprensión de los científicos sobre cómo se construye y cómo funciona el NPC humano. Los descubrimientos del equipo abren la puerta a mucha más investigación. "Habiendo determinado su estructura, ahora podemos centrarnos en la elaboración de las bases moleculares para las funciones de la NPC, como la forma en que se exporta el ARNm y las causas subyacentes de las muchas enfermedades asociadas a la NPC con el objetivo de desarrollar nuevas terapias", dice Hoelz.
Los artículos que describen el trabajo aparecen en la edición del 10 de junio de la revista Science . Los bioquímicos resuelven la estructura del guardián del ADN de las células