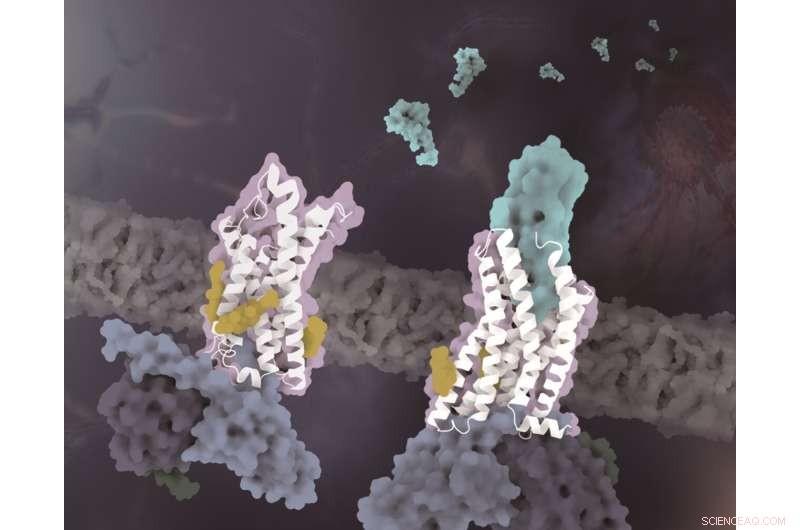
Las estructuras de CX3CR1 en distintos estados conformacionales. El CX3CR1 tanto en estado libre de ligando como en estado unido a CX3CL1 es de color blanco. El CX3CL1 es de color cian, los colesteroles son de color amarillo y las tres subunidades de la proteína G son de color azul claro, azul oscuro y verde oscuro, respectivamente. Crédito:laboratorio de Zhao Qiang en SIMM
Los receptores de quimiocinas regulan la migración de las células inmunitarias y están implicados en la inflamación, la formación de tumores y la infección por patógenos. Las quimiocinas se dividen en cuatro subfamilias según el número y la distribución de cisteínas conservadas en el extremo N:CC, CXC, CX3C y XC.
Las quimiocinas reconocen sus receptores en la misma subfamilia, lo que complica el desarrollo de fármacos dirigidos. Como el único miembro de la subfamilia de receptores de quimiocinas CX3C, CX3CR1 presenta una ventaja única como posible diana farmacológica en el tratamiento de la aterosclerosis, el cáncer y la neuropatía. Sin embargo, el desarrollo del fármaco CX3CR1 se ve obstaculizado parcialmente por la falta de información estructural que rige el reconocimiento de quimiocinas y la activación del receptor.
En un estudio publicado en Science Advances El 29 de junio, un equipo de investigación dirigido por Zhao Qiang y Wu Beili del Instituto de Materia Médica de Shanghái (SIMM) de la Academia de Ciencias de China hizo un gran avance en el campo de los receptores de quimiocinas al resolver las estructuras de microscopía crioelectrónica de CX3CR1. -Gi y complejos CX3CR1-CX3CL1-Gi.
Aunque se han resuelto varias estructuras complejas de receptores de quimiocinas en las subfamilias CC y CXC, el mecanismo molecular del reconocimiento único de CX3CR1 y CX3CL1 sigue siendo desconocido. Con el análisis de las estructuras y la alineación de secuencias, los investigadores descubrieron que las características estructurales únicas del bucle 30s en CX3CL1 y la región ECL2 en CX3CR1 desempeñan un papel clave en el mecanismo de reconocimiento con complementariedad de forma. En comparación con las quimiocinas CC y CXC, el motivo CX3C específico de CX3CL1 da como resultado un mayor cambio del bucle 30s hacia CX3CR1 ECL2.
Como el ECL2 de CX3CR1 contiene menos residuos que otros receptores de quimiocinas, el ECL2 más corto en la estructura CX3CR1-CX3CL1 proporciona suficiente espacio para el bucle de 30 s de CX3CL1. Sin embargo, el bucle 30s de otras subfamilias de quimiocinas exhibe una conformación no extendida, que es complementaria a la superficie de ECL2 más larga de los receptores correspondientes.
Esta es la primera vez que los científicos proporcionan la base estructural para dilucidar el mecanismo molecular del reconocimiento específico entre CX3CR1 y su ligando endógeno único.
Además de la especificidad del reconocimiento de señales quimiotácticas, otro hallazgo importante de este estudio revela que las moléculas de colesterol regulan la activación de CX3CR1. En las estructuras complejas de los estados activados constitutivamente y unidos a CX3CL1, se observaron tres colesteroles para estabilizar la hélice VI de CX3CR1 con un cambio conformacional mucho menor que las estructuras complejas de clase A GPCR-Gi resueltas previamente. Con el respaldo de los datos funcionales de CX3CR1 y otros receptores de quimiocinas, se verifica aún más que los colesteroles desempeñan funciones específicamente esenciales en la estabilización de la conformación y la transducción de señales de CX3CR1.
Este estudio proporciona información sobre el mecanismo único de reconocimiento de quimiocinas para la subfamilia de receptores de quimiocinas humanas. Los distintos sitios de unión al colesterol de CX3CR1 profundizan nuestro conocimiento sobre la modulación de los colesteroles en los GPCR. Los científicos logran un gran avance en la comprensión de los receptores de serotonina