Crédito:CC0 Dominio público
Un péptido novedoso desarrollado en las Universidades de Bayreuth y Bristol es eminentemente adecuado para el transporte dirigido de moléculas—por ejemplo, de sustancias activas y tintes—en las células de los mamíferos. El péptido se caracteriza por una doble función:puede entrar en la célula desde el exterior e interactuar allí con un péptido asociado. El péptido asociado debe haber sido colocado previamente dentro de la célula exactamente donde las moléculas transportadas deben tener efecto. El sistema de transporte presentado en la revista Nature Chemical Biology ejemplifica el potencial prometedor de un diseño de novo de péptidos y proteínas.
En los últimos años, la biomedicina y la farmacología han desarrollado un gran número de sustancias activas capaces de desencadenar, potenciar o inhibir procesos en células de mamíferos. Sin embargo, transportar estas sustancias exactamente al lugar donde se requieren sigue siendo un desafío en muchos casos. La situación es similar cuando se trata de marcar con color ciertas estructuras dentro de las células con fines de investigación o diagnóstico. Es cierto que las células de los mamíferos tienen la capacidad de incorporar sustancias extrañas a través de la endocitosis. Pero esto de ninguna manera garantiza el transporte al lugar de acción deseado. Un nuevo enfoque de investigación que la bioquímica de Bayreuth Prof. Dr. Birte Höcker está siguiendo con su grupo de investigación es el diseño racional de péptidos. Estos deberían poder penetrar en el interior de la célula desde el exterior y tomar sustancias activas adheridas o moléculas de colorante con ellos. Los péptidos adecuados para este propósito son más bien pequeños, ya que normalmente constan de menos de 30 aminoácidos.
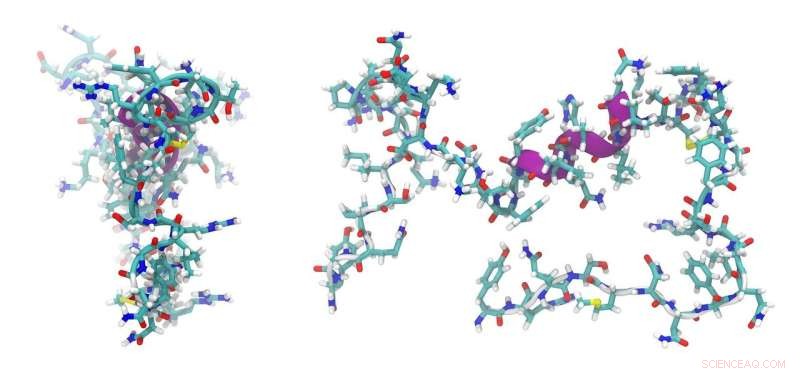
Sin embargo, hasta ahora el problema ha sido que este tipo de péptidos, precisamente por su sencillez y pequeño tamaño, no ofrecen muchas aplicaciones posibles. Esto se debe a que solo hay unas pocas áreas en las diversas estructuras del interior celular donde pueden acoplarse y entregar las moléculas que transportan. Esta desventaja ha sido superada por el péptido desarrollado en Bayreuth y Bristol. Es un péptido básico con un alto contenido en aminoácidos de arginina, y tiene dos componentes esenciales para su funcionalidad. Uno permite que el péptido entre en el interior de la célula y el otro puede interactuar con un péptido socio ácido. Este péptido asociado es tal que se puede colocar en lugares muy diferentes dentro de la célula usando métodos bioquímicos establecidos. Una vez que las proteínas, los complejos moleculares más grandes o los orgánulos han sido marcados con el péptido asociado, pueden ser el objetivo del péptido básico que ha ingresado a la célula. Como una llave en una cerradura, el péptido básico se adhiere al péptido ácido. La ubicación específica del péptido compañero ácido se logra acoplándolo con moléculas que a su vez se introducen en el ADN de la célula mediante transfección.
El equipo de investigación anglo-alemán diseñó los dos péptidos de novo previamente desconocidos utilizando métodos de diseño de proteínas asistido por computadora. La base de este trabajo fueron los péptidos con una estructura enrollada, que se describieron en una base de datos de estructuras. Los péptidos diseñados en la computadora fueron luego sintetizados en el laboratorio. Aquí, se utilizaron métodos biofísicos y cristalografía de rayos X para identificar las propiedades reales y el comportamiento de los péptidos. Los experimentos con bacterias E. coli y células eucariotas revelaron que el nuevo sistema de péptidos es incluso adecuado para transportar otros péptidos y proteínas.
"Our investigations exemplify how the computational design of peptides and proteins, their subsequent synthesis and characterization in the laboratory, as well as testing in living cells can intertwine when innovative solutions for biochemical or biomedical questions are being sought," says Prof. Dr. Birte Höcker, head of the Protein Design Group at the University of Bayreuth and corresponding author of the new study.
"The new peptide system makes it clear that de novo design is a promising research approach in the search for methods that enable drug or dye molecules to be introduced into mammalian cells in a targeted and gentle manner," adds Dr. Guto Rhys, postdoc at the Protein Design research group and one of the three first authors. Fluorescent peptide nanoparticles, in every color of the rainbow