
Figura 1. Una nueva técnica para observar AFM en membranas de células vivas utilizando una membrana porosa de nitruro de silicio (MPM). (a) La aparición de MPM. (b) Los agujeros de MPM observados por AFM. (c) El MPM cuando se establece en la cámara para observación. ( d ) Esquema de la observación de la superficie celular de AFM utilizando MPM. Crédito:Universidad de Kanazawa
Investigadores de la Universidad de Kanazawa informan en Biología de las comunicaciones que el uso de productos químicos comunes para fijar muestras de células vivas para estudios de microscopía hace que las proteínas de membrana se agreguen.
Para investigaciones histológicas de tejidos biológicos, es decir, estudios anatómicos bajo el microscopio, las muestras generalmente se fijan para evitar que se deterioren. La fijación generalmente se realiza sumergiendo o perfundiendo la muestra en un químico; los aldehídos y los alcoholes son fijadores comunes. Se ha especulado que las proteínas de membrana que se mueven hasta cierto punto en una membrana celular pueden formar agregados durante la fijación. Sin embargo, se necesitan estudios detallados de la superficie celular con resolución a escala nanométrica para obtener información definitiva sobre este problema potencial. Ahora, Takehiko Ichikawa y sus colegas de la Universidad de Kanazawa han realizado estudios de microscopía de fuerza atómica (AFM) de superficies de células de mamíferos vivos. Al comparar muestras no fijadas y fijadas, descubrieron que la fijación de hecho conduce a cambios estructurales.
Los investigadores desarrollaron un método para utilizar una membrana microporosa de nitruro de silicio (MPM), utilizada en la microscopía electrónica de transmisión (Figura 1), para obtener imágenes AFM. Es importante destacar que MPM puede hacer que la superficie de la celda sea plana y evitar fluctuaciones al apoyar el área fuera del área de observación. En las imágenes AFM de las superficies de las células de cáncer de colon cultivadas en MPM, las estructuras biomoleculares de las membranas celulares aparecieron como protuberancias con un tamaño típico de unos pocos nanómetros (Figura 2, superficie de células vivas).
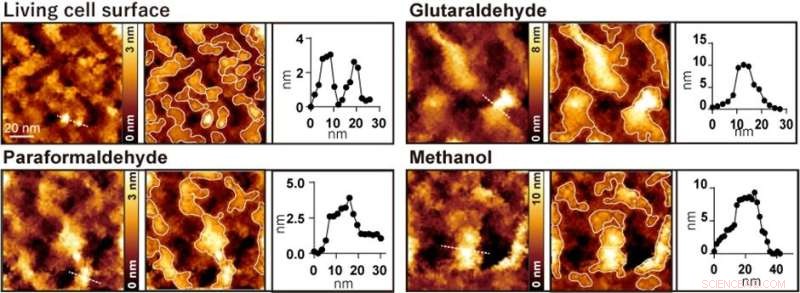
Figura 2. Observación de la superficie celular de AFM antes y después del tratamiento con glutaraldehído, paraformaldehído y metanol, respectivamente. La imagen de la izquierda es una imagen AFM, la imagen del centro es una imagen AFM con las protuberancias enmarcadas y la imagen de la derecha es un perfil de altura a lo largo de la línea de puntos en la imagen de la izquierda. Crédito:Universidad de Kanazawa
Cuando las células se trataron con fijadores de uso común, como paraformaldehído, glutaraldehído y metanol, desaparecieron algunas estructuras nanométricas y solo se observaron grandes protuberancias con diámetros que oscilaban entre 20 y 100 nanómetros (Figura 2). Los investigadores realizaron varios experimentos de fluorescencia y concluyeron que las grandes protuberancias observadas después de la fijación se formaron por la agregación de proteínas de membrana.
El estudio demuestra que los agregados observados son artefactos resultantes del proceso de fijación. Esto debería llamar a la cautela entre la comunidad de investigadores que trabajan con fijadores químicos. Citando a Ichikawa y sus colegas:"Los investigadores que observan grupos a nanoescala también deben tener cuidado al interpretar sus resultados experimentales cuando usan células fijas. Recomendamos que los investigadores usen células vivas tanto como sea posible para evitar el efecto de la fijación cuando investigan grupos a nanoescala".
El principio general detrás de la microscopía de fuerza atómica (AFM) es hacer que una punta muy pequeña escanee la superficie de una muestra. Durante este escaneo horizontal (xy), la punta, que está unida a un pequeño voladizo, sigue el perfil vertical (z) de la muestra, induciendo una fuerza en el voladizo que se puede medir. La magnitud de la fuerza en la posición xy se puede relacionar con el valor z; los datos xyz generados durante un escaneo dan como resultado un mapa de altura que proporciona información estructural sobre la muestra investigada. AFM no se ve afectado por el límite de difracción debido al uso de haces de luz o de electrones y puede observar la topografía de la superficie intacta con alta resolución. Asignación de características móviles en microscopía de fuerza atómica de alta velocidad