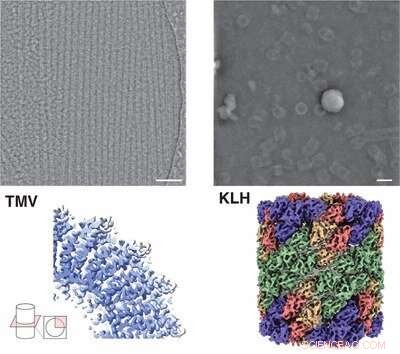
Imagen microscópica (arriba) y estructura (abajo) de la proteína hemocianina (derecha) y virus del mosaico del tabaco (izquierda) por iDPC-STEM. Debajo de las estructuras 3D correspondientes a una resolución de 3,5 y 6,5 Å. Crédito:Forschungszentrum Jülich / Ivan Lazic, Carsten Sachse
Investigadores del Forschungszentrum Jülich y de la Universidad Heinrich Heine de Düsseldorf, dirigidos por el Prof. Dr. Carsten Sachse, están utilizando criomicroscopía electrónica, o crio-EM para abreviar, para hacer visibles las biomoléculas a nivel atómico. En un artículo publicado ahora en la revista Nature Methods , presentan un nuevo método que combina crio-EM con un método utilizado en la investigación de materiales. Los resultados también se presentan y clasifican en una Naturaleza Instrucciones.
La todavía relativamente nueva técnica de crio-EM tiene una ventaja decisiva sobre la cristalografía de rayos X que se ha utilizado de forma rutinaria durante décadas:los componentes básicos de las proteínas se pueden observar en su entorno natural en un estado ultracongelado sin tener que convertirlos en un cristal artificial de antemano. Cryo-EM se basa en la microscopía electrónica de transmisión. El método alternativo que los investigadores han empleado ahora, por otro lado, es un desarrollo adicional de microscopía electrónica de transmisión de barrido con contraste de fase diferencial integrado, o iDPC-STEM para abreviar.
"Hasta ahora, este método se ha utilizado principalmente en la investigación de materiales, donde ya ha dado lugar a resoluciones muy altas. Al obtener imágenes de muestras biológicas, ahora hemos logrado directamente una calidad que fue posible por primera vez gracias a la criomicroscopía electrónica hace unos años. " dice Carsten Sachse, director del Ernst Ruska-Centre de Forschungszentrum Jülich y profesor de la Universidad Heinrich Heine de Düsseldorf.
Junto con socios de investigación de la empresa de análisis Thermo Fisher Scientific en Eindhoven, pudo mapear estructuras de proteínas utilizando iDPC-STEM con una resolución subnanométrica de 3,5 angstroms. "En comparación, la microscopía crioelectrónica es un poco más avanzada hoy en día. Pero nuestros resultados muestran que, en principio, iDPC-STEM es capaz, con alguna optimización, de lograr resoluciones similares a las crio-EM actuales y ampliar las posibilidades del análisis estructural, especialmente para muestras muy heterogéneas, no uniformes o partículas individuales cuando las capacidades de promediación son limitadas", dice Carsten Sachse.

Representación artística del enfoque de microscopía electrónica de transmisión de barrido (STEM):un pequeño haz de electrones rasga sobre la muestra en pequeños pasos para iluminar las biomoléculas congeladas instantáneamente en el hielo. Crédito:Forschungszentrum Jülich/Daniel Mann, Carsten Sachse
En la microscopía crioelectrónica convencional, se toman miles, a veces decenas o cientos de miles, de instantáneas de una muestra desde muchas direcciones de visualización. Una poderosa computadora usa estas imágenes para calcular un modelo tridimensional detallado de la molécula o partícula. La microscopía electrónica de barrido, por otro lado, escanea objetos línea por línea en pequeños pasos para producir una imagen compuesta que, como en la crio-EM convencional, sirve como base para el cálculo de la estructura tridimensional. Al igual que con la microscopía crioelectrónica, se utiliza un haz de electrones de baja dosis porque las biomoléculas suelen ser extremadamente sensibles. Esto evita que la alta energía del haz destruya las estructuras sensibles. Criomicroscopía electrónica:uso de tecnología económica para producir imágenes de alta resolución