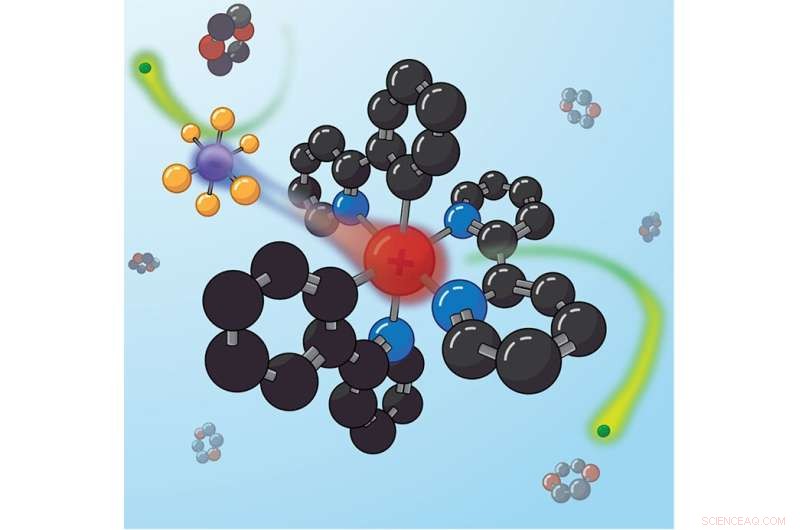
Los pares de iones estrechamente unidos se reorganizan después de la fotoexcitación para minimizar el momento dipolar general, que puede bloquear tipos específicos de reacciones de transferencia de electrones. Crédito:Justin Earley, NREL
Como explicó una vez el poeta Dylan Thomas, es "la fuerza que a través de la mecha verde impulsa la flor".
La fotoquímica orgánica trae vida a la Tierra, permitiendo que las plantas "coman" la luz del sol. Usar este poder de la luz para crear nuevas moléculas en el laboratorio en lugar de la hoja, desde combustible hasta productos farmacéuticos, es uno de los grandes desafíos de la investigación fotoquímica.
Lo viejo es nuevo otra vez. A veces, obtener nuevos conocimientos requiere volver a las herramientas antiguas, con un toque moderno. Ahora, un equipo de colaboración del Laboratorio Nacional de Energía Renovable (NREL) y la Universidad de Princeton ha resucitado una técnica de microondas centenaria para revelar una característica sorprendente de la química bien establecida impulsada por la luz.
Publicado en Química de la Naturaleza , "La reorganización de pares de iones regula la reactividad en catalizadores fotoredox" documenta el trabajo dirigido por Garry Rumbles, miembro de Química y Nanociencia del NREL, el profesor de investigación Obadiah Reid y el estudiante graduado de la Universidad de Colorado Boulder, Justin Earley. El trabajo se llevó a cabo como parte del Instituto de Energía Sostenible y Renovable (RASEI), un instituto conjunto entre NREL y la Universidad de Colorado Boulder.
Este trabajo, que forma parte de un Centro de Investigación de Fronteras Energéticas del Departamento de Energía de EE. UU. (DOE) titulado Bioinspired Light-Escalated Chemistry (BioLEC) con sede en la Universidad de Princeton, revela cómo opera una clase importante de "catalizadores fotoredox", lo que lleva a formas imprevistas de manipular su eficiencia y selectividad.
La catálisis fotoredox es una rama de la fotoquímica que ha regresado en los últimos años, utilizando luz en lugar de calor o productos químicos altamente reactivos para impulsar reacciones químicas. Esto hace posible impulsar reacciones con altas barreras cinéticas o termodinámicas con un mejor control sobre el producto final e ingredientes potencialmente menos dañinos.
Sin embargo, para usar estas nuevas reacciones a escala de fabricación, se requiere una comprensión detallada de cómo funciona la reacción.
"Comenzamos este trabajo para aprender cómo se mueven las cargas durante las reacciones impulsadas por la luz", dijo Reid. "Pero nunca esperábamos que el primer catalizador que estudiamos nos sorprendiera así".
El catalizador estudiado por el equipo de NREL era un compuesto iónico compuesto por dos mitades. Una mitad estaba cargada positivamente y la otra era negativa, de modo que la carga total sumaba cero. En este caso, se pensaba que el lado positivo hacía todo el trabajo en las reacciones químicas impulsadas por la luz, mientras que el lado negativo era un "contraión" supuestamente inerte.
"Descubrimos que el contraión en realidad se mueve cuando el catalizador es excitado por la luz y que puede bloquear ciertos tipos de reacciones", dijo Reid. "Al igual que un apoyador, a veces tu trabajo es simplemente estorbar. Eso es justo lo que hace el contraataque".
Al medir exactamente cómo cambiaba su señal de microondas a medida que pasaba a través de la solución, con y sin luz, el equipo demostró que el contraión con carga negativa se movía después de que la molécula se excitaba con la luz. "Esto es importante", dijo Earley, "porque las moléculas necesitan un camino para que los electrones se muevan a fin de iniciar una reacción química, y el contraión puede bloquearlo". El equipo descubrió que la acción de bloqueo del contraión condujo a un cambio de factor de cuatro entre dos tipos diferentes de reacciones.
Rumbles dijo que aunque la herramienta de medición utilizada por el equipo de NREL existe desde hace más de 100 años, históricamente los científicos tuvieron que realizar experimentos de control que requerían mucho tiempo para interpretar sus resultados. Las computadoras cambiaron eso. En cambio, el equipo de NREL utilizó simulaciones cuantitativas de cómo giran las moléculas del catalizador en solución para ayudar a interpretar sus resultados. Hacer que las moléculas estables reaccionen con la luz