Gráficamente abstracto. Crédito:DOI:10.1038 / s41589-021-00841-3
La colecistoquinina (CCK) y la gastrina son las primeras hormonas gastrointestinales descubiertas. Son los péptidos más abundantes en el tracto gastrointestinal y el sistema nervioso central, actuando como hormonas y neurotransmisores fisiológicamente importantes a través de dos subtipos de receptores CCK, CCKAR y CCKBR.
Estos dos receptores participan en acciones fisiológicas fundamentales como la regulación de la saciedad, secreción de enzimas pancreáticas, y contracción de la vesícula biliar. También están implicados en procesos conductuales, incluyendo ansiedad, memoria, y adicción a las drogas. Sin embargo, El desarrollo de fármacos contra los receptores de colecistoquinina (CCKR) es un desafío principalmente debido a la falta de información estructural precisa.
En dos estudios ambos publicados en Biología química de la naturaleza , el equipo de investigación dirigido por Jiang Yi, Wang Mingwei, H. Eric Xu, Zhao Qiang, y Wu Beili del Instituto de Materia Médica de Shanghai de la Academia de Ciencias de China y el equipo de investigación dirigido por Zhao Suwen de la Universidad ShanghaiTech, juntos revelaron los mecanismos de reconocimiento de ligandos, activación y especificidad de acoplamiento de proteína G de CCKR.
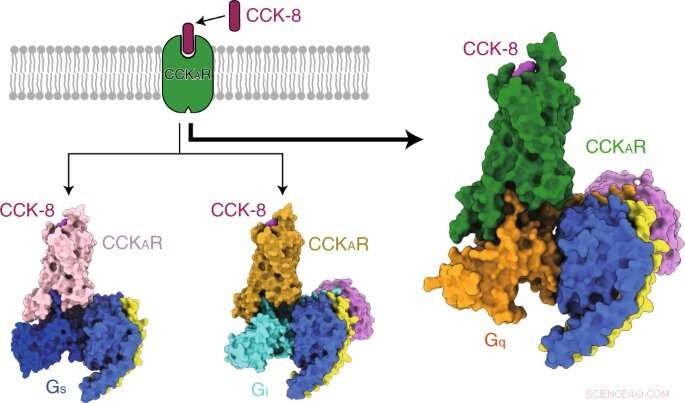
Los investigadores primero resolvieron tres estructuras cristalinas del CCKAR humano en complejo con dos antagonistas de moléculas pequeñas (lintitript y devazepide) y un agonista completo NN9056, así como cinco estructuras de microscopía crioelectrónica (crio-EM) de CCKAR activado por CCK-8 en un complejo con tres proteínas G (Gi, Gs, y Gq) y CCKBR activado por gastrina acoplado a dos proteínas G (Gi y Gq). Aclararon los mecanismos de reconocimiento de CCKR por ligandos, Activación de CCKR, y promiscuidad de proteína G de CCKAR, todo lo cual proporciona información fundamental para el descubrimiento de fármacos de CCKR.
Luego, los investigadores presentaron las estructuras de CCKAR unido a CCK-8 sulfatado en complejo con Gq, Gs, y heterotrímeros Gi a resoluciones globales de 2,9 angstrom, 3.1 angstrom, y 3.2 angstrom, respectivamente. Descubrieron el modo de unión del péptido endógeno CCK-8, y encontró que la sulfo-tirosina en CCK-8 era crucial para la alta afinidad del péptido endógeno por CCKAR.
Consecuentemente, los investigadores encontraron que la proteína Gq mostraba la actividad de acoplamiento más potente de CCKAR. Estos resultados apoyaron a Gq como el transductor predominante de CCKAR y destacaron la importancia del área de la interfaz en la selectividad de acoplamiento de la proteína G.
Es más, los investigadores informaron de tres estructuras cristalinas de CCKAR unidas a pequeños antagonistas moleculares y un agonista peptídico, así como dos estructuras crio-EM de complejos CCKBR acoplados a Gi- y Gq. Revelaron el modo de unión de los CCKR tanto por péptidos como por ligandos de moléculas pequeñas, e identificaron roles fundamentales en el reconocimiento de CCKAR por devazepide y lintitript, proporcionando así una plantilla para diseñar fármacos dirigidos a los CCKR.
Combinando las estructuras inactivas y activas de CCKAR con el análisis de simulación molecular, los investigadores propusieron el proceso de activación gradual de CCKAR.
Los hallazgos de estos dos estudios ofrecieron la primera información sobre el reconocimiento de ligandos y la activación de los dos receptores CCK y brindaron una nueva oportunidad para diseñar fármacos dirigidos a los CCKR.