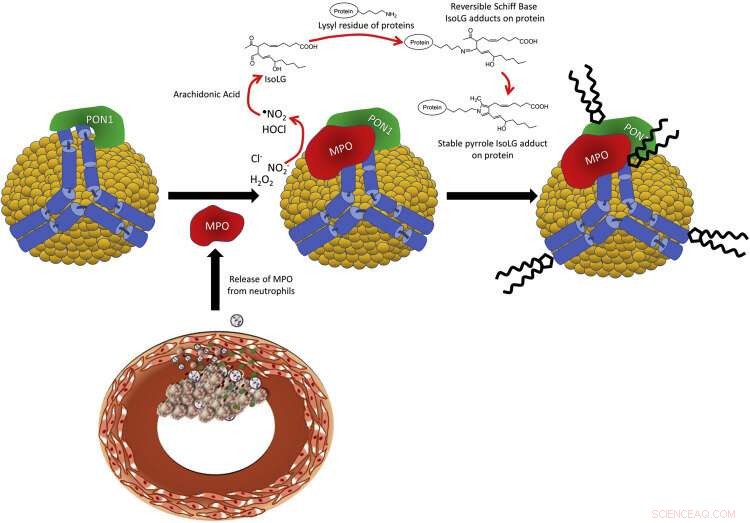
Figura 1. Esquema de la interacción de PON1 / MPO con apoA-I en HDL y la producción de IsoLG. Los neutrófilos activados en el sitio de las lesiones ateroscleróticas liberan MPO, que se asocia con HDL circulante. MPO forma un complejo ternario con apoA-I y PON1. La MPO cataliza la formación de especies reactivas de oxígeno, como el hipoclorito, que peroxida el ácido araquidónico para formar IsoLG. IsoLG reacciona extremadamente rápido con aminas primarias como los residuos de lisilo de proteínas HDL como apoA-I para formar aductos covalentes. Crédito:DOI:10.1016 / j.jbc.2021.101019
PON1 (paraoxonasa 1), una enzima asociada con la lipoproteína de alta densidad (HDL), descompone los peróxidos de lípidos, Moléculas grasas altamente reactivas que pueden dañar los vasos sanguíneos.
De este modo, PON1 puede proteger contra el desarrollo de enfermedades cardiovasculares. Numerosos estudios han observado una actividad enzimática reducida de PON1 en pacientes con enfermedad cardiovascular.
Reportando el mes pasado en el Revista de química biológica , Sean Davies, Doctor., y sus colegas demuestran in vitro que otras moléculas reactivas llamadas isolevuglandinas (IsoLG) pueden modificar directamente PON1, y esa modificación directa es el mecanismo principal por el cual IsoLG reduce la actividad de PON1.
En colaboración con MacRae Linton, MARYLAND, y colegas, El grupo de Davies mostró previamente en un modelo de ratón que las moléculas depuradoras que se unen y eliminan las IsoLG del torrente sanguíneo mejoran significativamente la actividad de PON1.
Si bien son necesarios más estudios in vivo para determinar en qué medida la modificación de PON1 con IsoLG contribuye a la reducción de la actividad enzimática, el estudio actual respalda la idea de que bloquear esta modificación podría resultar beneficioso para reducir la aterosclerosis, concluyeron los investigadores.