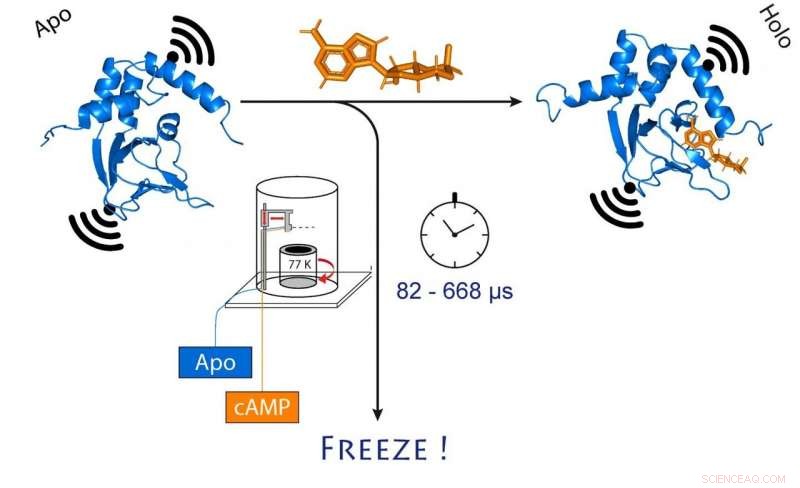
cuando cAMP (naranja) se une. Esto también cambia la distancia entre los dos imanes moleculares conectados al canal (negro). Crédito:(c) Tobias Hett / Universität Bonn und Forschungszentrum caesar
Investigadores de la Universidad de Bonn y el Centro de Investigación Caesar han logrado congelar proteínas ultrarrápidas después de un período de tiempo definido con precisión. Pudieron seguir los cambios estructurales en una escala de tiempo de microsegundos y con una precisión subnanométrica. Debido a su alta resolución espacial y temporal, el método permite rastrear cambios estructurales rápidos en enzimas y ácidos nucleicos. Los resultados se publican en el Revista de la Sociedad Química Estadounidense.
Si quieres saber cómo es la estructura espacial de una biomolécula, tienes un formidable arsenal de herramientas a tu disposición. Los más populares son la microscopía electrónica y la difracción de rayos X, que puede revelar incluso los detalles más pequeños de una proteína. Sin embargo, una limitación importante de esos métodos es que suelen ofrecer imágenes estáticas, que a menudo son insuficientes para comprender los procesos biomoleculares en términos mecanicistas precisos. Por lo tanto, Un objetivo a largo plazo de muchos grupos de investigación en todo el mundo ha sido rastrear los movimientos dentro de una macromolécula, como una proteína, a lo largo del tiempo mientras realiza su trabajo. como en una película. Los grupos de investigación dirigidos por el Prof.Dr. Olav Schiemann del Instituto de Química Física y Teórica de la Universidad de Bonn y el Prof.Dr. Benjamin Kaupp del Centro de Investigación césar de la Sociedad Max Planck han dado un paso más hacia la consecución de este objetivo. objetivo.
Eligieron un canal de iones para su investigación. Esta es una proteína que forma minúsculos poros en la membrana celular que son permeables a las partículas cargadas llamadas iones. "Este canal normalmente está cerrado, ", Explica Schiemann." Solo se abre cuando un mensajero celular, llamado cAMP, se une a él. Queríamos saber cómo funciona exactamente este proceso ".
Mini imanes para medir distancias
Para hacerlo los investigadores primero mezclaron la proteína del canal y el cAMP y luego congelaron rápidamente la solución. En el estado congelado ahora se puede analizar la estructura de la proteína. Para que su método funcione, habían colocado electroimanes moleculares en dos puntos del canal. La distancia entre estos imanes se puede determinar con una precisión de unos pocos Angstrom (diez mil millonésimas de milímetro) utilizando un método sofisticado llamado PELDOR, que funciona como una regla molecular. En años recientes, el método se refinó y mejoró significativamente en el grupo de Schiemann.
"Sin embargo, esto solo nos da una imagen estática de cAMP que se une al canal iónico, "Dice Schiemann." Por lo tanto, repetimos el proceso de congelación en diferentes momentos después de mezclar las dos moléculas. Esto permitió reconstruir los movimientos de la proteína después de la unión de cAMP, como en una película, que también se compone de una secuencia de imágenes ".
En el centro de este procedimiento se encuentra un método sofisticado que permite mezclar y congelar muestras muy rápidamente en un momento preciso. La técnica, llamado "hiperflujo de congelación de microsegundos" (abreviado MHQ), fue desarrollado originalmente en la Universidad de Delft, pero luego cayó en desuso. Fue redescubierto y refinado decisivamente por el grupo de Kaupp.
"En el dispositivo MHQ, la molécula de AMPc y el canal iónico se mezclan a una velocidad ultrarrápida, "Kaupp explica." Luego, la mezcla se dispara como un chorro fino de un cabello en un cilindro de metal muy frío a -190 ° C, que gira 7, 000 veces por minuto. Fue particularmente desafiante transferir las muestras congeladas para la medición PELDOR desde la placa de metal a tubos delgados de vidrio, y mantenerlos congelados mientras tanto. Tuvimos que diseñar y construir herramientas especiales para eso ".
Congelación profunda en 82 millonésimas de segundo
Todo el proceso de mezcla y congelación toma solo 82 microsegundos (un microsegundo equivale a una millonésima de segundo). "Esto nos permite visualizar cambios muy rápidos en la estructura espacial de las proteínas, "explica Tobias Hett, uno de los dos estudiantes de doctorado que contribuyó significativamente al éxito. La ventaja del método es su combinación de alta resolución espacial y temporal. "Esto representa un gran paso adelante en el estudio de procesos dinámicos en biomoléculas, "Enfatiza Kaupp.
Los investigadores ahora planean usar su método para observar más de cerca otras biomoléculas. Esperan obtener nuevos conocimientos por ejemplo en el funcionamiento de enzimas y ácidos nucleicos. La importancia de tales conocimientos se ilustra mejor con el reciente aumento mundial de la investigación estructural sobre el coronavirus-2 del SARS:la llamada proteína de pico del virus también sufre un cambio estructural cuando las células humanas están infectadas. Aclarar este mecanismo proporcionará información valiosa sobre cómo atacar el mecanismo de infección con nuevos fármacos.
La preparación de las muestras, la ejecución experimental, y el análisis de los datos es muy complejo. Por lo tanto, los resultados del estudio también reflejan una cooperación científica exitosa con investigadores dirigidos por el Prof.Dr. Helmut Grubmüller del Instituto Max Planck de Química Biofísica en Göttingen y el Prof. Dr. Heinz-Jürgen Steinhoff de la Universidad de Osnabrück.