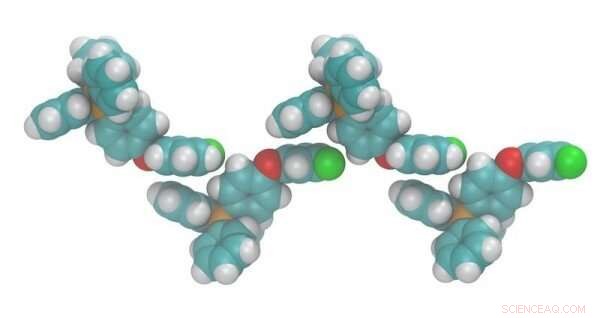
Simulación de una sal fluorada que demuestra la alineación catiónica. La adición de átomos de flúor electronegativos (verde) conduce a la alineación con los centros de fósforo electropositivo (naranja) en la fase sólida, lo que provoca interacciones que reducen el punto de fusión. Crédito:Brooks Rabideau, Universidad del Sur de Alabama, Ingeniería química y biomolecular y la Royal Society of Chemistry
Aunque las cargas opuestas siempre se atraen, no siempre interactúan lo más estrechamente posible. En un nuevo estudio, Los investigadores utilizaron una combinación de experimentos y simulaciones moleculares para demostrar los efectos de cambiar sutilmente la estructura de los cationes cargados positivamente en compuestos formados por iones. Estos cambios animan a los cationes a alinearse entre sí en la fase sólida de la materia. Esto disminuye algunos tipos de interacciones potenciales entre cationes y aniones cargados negativamente en la fase sólida. Esta alineación catiónica también disminuye el punto de fusión del compuesto iónico, a menudo de forma significativa.
Muchos procesos químicos requieren líquidos como solventes para reacciones químicas, lubricantes fluidos de transferencia de calor. Los líquidos a menudo se vaporizan en el proceso. Esto puede generar emisiones peligrosas. Los compuestos iónicos líquidos (líquidos iónicos) ofrecen una solución a este problema porque tienen una volatilidad muy baja, lo que significa que es menos probable que se vaporicen. Algunos líquidos iónicos son estables a altas temperaturas, pero sus puntos de fusión pueden ser demasiado altos para un uso práctico. Los resultados de este trabajo proporcionan a los científicos un nuevo conjunto de herramientas para diseñar compuestos iónicos con puntos de fusión más bajos. Estos resultados permitirán a los científicos diseñar compuestos iónicos para su uso en una gama más amplia de temperaturas y aplicaciones.
Los líquidos iónicos son sales que son líquidos a la temperatura a la que se utilizan. Estos líquidos tienen una variedad de usos potenciales en procesos ambientalmente benignos. En particular, Los líquidos iónicos térmicamente estables se muestran prometedores como disolventes de alta temperatura y fluidos de transferencia de calor. Sin embargo, estos líquidos iónicos pueden tener puntos de fusión muy por encima de la temperatura ambiente. Esto limita su procesabilidad a temperaturas más bajas. Por lo tanto, comprender cómo reducir el punto de fusión de estos compuestos ampliará su uso potencial y permitirá tecnologías que dependen de ellos.
Los científicos saben que los cambios estructurales, específicamente aquellos que imparten una asimetría significativa, Disminuir los puntos de fusión de una amplia variedad de compuestos. Estas modificaciones estructurales no son posibles mientras se mantienen compuestos térmicamente resistentes, ya que muchas estructuras químicas comunes tienen baja estabilidad térmica. Los investigadores han demostrado en el estudio actual que los cambios estructurales sutiles que también aumentan el momento dipolar del catión pueden reducir significativamente los puntos de fusión. La simulación computacional proporciona información a nivel molecular y demuestra que el aumento del momento dipolar hace que los cationes se alineen entre sí en la fase sólida. Esto, a su vez, frustra las interacciones anión / catión y aumenta la entalpía de la fase sólida (una medida de calor o trabajo en el sistema). Este aumento en la entalpía de la fase sólida disminuye la entalpía de fusión dando como resultado puntos de fusión más bajos. Este estudio proporciona una regla de diseño para reducir el punto de fusión de líquidos iónicos estructuralmente similares al alterar su momento dipolar.