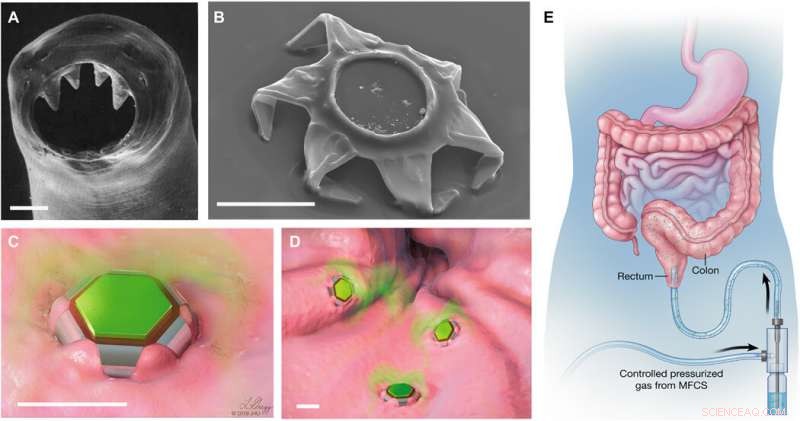
Theragrippers que cambian de forma como dispositivos de administración de fármacos con autobloqueo. (A) Imagen de microscopía electrónica de barrido (SEM) de los dientes ventriculares de la anquilostomiasis A. duodenale. El gusano usa estos dientes afilados para penetrar la mucosa y se adhiere en el tracto gastrointestinal hasta por 2 años. Reimpreso de Human Parasitology, 4ª Ed. Copyright 2013, con permiso de Elsevier. (B) Imagen SEM de un theragripper en la configuración cerrada. Como la anquilostomiasis los theragrippers están equipados con micropuntas afiladas. Ilustraciones esquemáticas de (C) un solo y (D) muchos theragrippers adheridos al tejido de la mucosa y liberando fármaco encapsulado (coloreado en verde). Barras de escala, 100 μm (A a D). (E) Ilustración conceptual de la administración rectal de theragrippers cargados con fármaco utilizando un controlador de flujo de microfluidos accionado por presión. Las imágenes (C) a (E) fueron ilustradas por L. Gregg. MFCS, sistema de control de flujo de microfluidos. Crédito:Science Advances, doi:10.1126 / sciadv.abb4133
La historia de portada en línea de Avances de la ciencia esta semana presenta un microdispositivo gastrointestinal (GI) conceptual, desarrollado por un equipo de investigación para la liberación prolongada de fármacos. Las plataformas de administración de fármacos para la liberación prolongada de fármacos han demostrado ser difíciles de desarrollar en bioingeniería debido a los movimientos del tracto gastrointestinal (GI) y su eliminación resultante del cuerpo. En un nuevo informe, Arijit Ghosh y un equipo de investigadores interdisciplinarios en ingeniería química y biomolecular, gastroenterología y hepatología, ciencia de los Materiales, El descubrimiento de fármacos y la neurología en la Universidad Johns Hopkins en los EE. UU. informaron sobre nuevos dispositivos cargados de fármacos bioinspirados por los mecanismos de agarre de los gusanos redondos parásitos conocidos como anquilostomas. Los parásitos pueden permanecer en el intestino delgado durante períodos prolongados alimentándose de la sangre de su huésped.
Ghosh y col. diseñaron y desarrollaron una construcción de agarre que llamaron theragrippers para clavar sus garras en el tejido mucoso del tracto intestinal. Los dispositivos realizaban agarre en respuesta al calor corporal u otras señales biológicas y liberaban fármacos en la luz GI. Como prueba de concepto, mostraron cómo los dispositivos se adhieren al tracto gastrointestinal de ratas vivas durante 24 horas y demostraron un aumento de seis veces en la vida media de eliminación de un fármaco antiinflamatorio no esteroideo utilizado para aliviar el dolor moderado. El trabajo mostró que el dispositivo ayudó a que el fármaco permaneciera en el cuerpo durante un período de tiempo significativamente más largo. El trabajo proporciona evidencia de primera en su clase sobre microdispositivos autobloqueantes para mejorar de manera efectiva la administración prolongada y mejorada de medicamentos.
Entrega de medicamentos en el tracto gastrointestinal.
En este trabajo, Ghosh y col. se inspiraron en el biomecanismo de Ancylostoma duodenale (anquilostomas) que residen en el intestino humano hasta por dos años. El trabajo presentó la primera evidencia preclínica de herramientas de enganche a escala submilimétrica para mejorar la liberación y retención de fármacos in vivo. La administración de fármacos a través del tracto gastrointestinal puede mejorar el cumplimiento en comparación con los inyectables. resultando en un mejor tratamiento. Los fármacos administrados a través del tracto GI permiten una absorción y una circulación sistémica eficientes debido a la enorme superficie intestinal y la rica vascularización de la mucosa del tracto GI. Por ejemplo, Los científicos habían desarrollado previamente partículas que penetran el moco (MPP) para mejorar la retención, aunque tales dispositivos se retiraron después de un día debido a la eliminación de la capa de moco subyacente. Por lo tanto, existe actualmente una necesidad urgente de desarrollar sistemas de administración de fármacos extendidos.
Representación esquemática de microdispositivos inspirados en anquilostomas que mejoraron el fármaco extendido Representación esquemática de microdispositivos inspirados en anquilostomas que mejoraron la administración extendida del fármaco en ratas. Crédito de la imagen:Lydia Gregg 2020 JHU, Avances científicos, doi:10.1126 / sciadv.abb4133 entrega en ratas. Crédito de la imagen:Lydia Gregg 2020 JHU, Avances científicos, doi:10.1126 / sciadv.abb4133
El experimento:desarrollo de theragrippers
Para lograr un enganche automático en la luz GI, Ghosh y col. se basó en la liberación de activación térmica del dispositivo. Colocaron un parche de carga de fármaco en los microactuadores para administrar ketorolaco (un analgésico) como fármaco modelo. Los theragrippers se mantuvieron en el colon durante 24 horas, permitiendo una exposición significativa a la droga, dando como resultado una concentración plasmática de ketorolaco 10 veces mayor 12 horas después de la administración. El trabajo de prueba de concepto validó el activo, Theragrippers que cambian de forma y se cierran automáticamente para una liberación prolongada del fármaco en el tracto gastrointestinal. Los científicos utilizaron múltiples micropuntas afiladas para diseñar los theragrippers que aseguran que se adhieran a la mucosa gastrointestinal de manera similar a los anquilostomas. Ellos taparon el grueso segmentos rígidos y bisagras bicapa de los theragrippers con una capa de cera termosensible. La capa de parafina o cera de la superficie del dispositivo se ablandó a la temperatura corporal después de la implantación para activar de forma autónoma las garras dentro del tracto gastrointestinal del modelo animal.
El equipo utilizó materiales híbridos que contenían un polímero metálico hecho de oro y cromo y que llevaban un parche de polímero liberador de fármacos para la liberación controlada de fármacos. La fuerza adhesiva del polímero cargado con fármaco al armazón metálico subyacente evitó la delaminación (eliminación) del parche de fármaco durante la peristalsis gastrointestinal. Los materiales eran biocompatibles sin toxicidad potencial para la administración de fármacos. El equipo seleccionó la vía rectal de administración del dispositivo más común para pacientes pediátricos y en intervenciones terapéuticas para la colitis ulcerosa.
La fluoresceína permitió la visualización de la liberación química de los agarradores. Crédito:Science Advances, doi:10.1126 / sciadv.abb4133 
Ghosh y col. Primero sintonizó la porosidad del parche de fármaco electrodepositado en el dispositivo para cargar y liberar fármacos durante 24 horas. Usaron ketorolaco, aprobado por la Administración de Drogas y Alimentos de EE. UU., no esteroideo, fármaco antiinflamatorio como candidato modelo con un alto perfil de aclaramiento (vida media de menos de 3 horas) para experimentos in vivo en un modelo de roedor. El tamaño de los poros del polímero facilitó la liberación de cantidades sustanciales de ketorolaco a una velocidad aceptable. y el equipo utilizó theragrippers de 250 µm para la administración de fármacos in vivo en ratas. Las construcciones eran 32 veces más pequeñas que el diámetro de colon típico en ratas y pesaban aproximadamente 300 g. Ghosh y col. sintonizado la penetración theragripper variando los parámetros de la construcción, y utilizó el método de elementos finitos para estimar la fuerza generada por las garras plegables del dispositivo. El equipo aplicó una restricción en la punta del theragripper para evitar que se pliegue durante las simulaciones y calculó la presión aproximada de cada micropunta del theragripper en el colon, que estaba en el rango de 0,4 a 0,6 MPa. Los resultados indicaron su potencial para ejercer suficiente presión para romper la barrera mucosa sin dañar el colon.
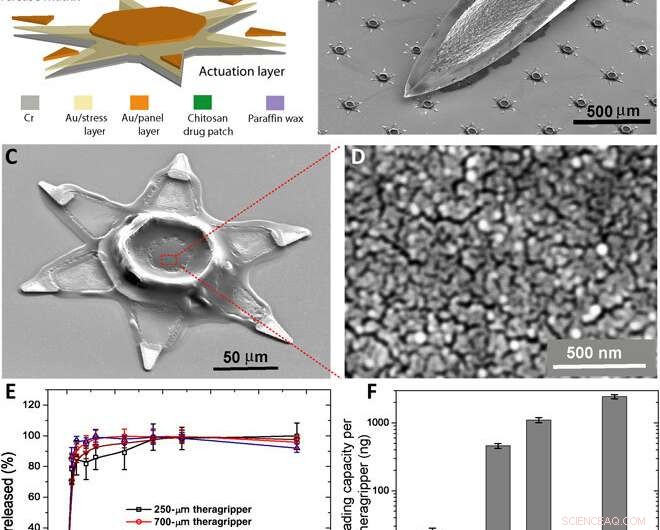
Fabricación paralela de los theragrippers y sus características de carga y liberación de fármacos in vitro. (A) Diagrama de bloques funcional que ilustra los pasos de microfabricación para una serie de theragrippers, mostrando la capa de actuación, capa liberadora de fármacos, y el gatillo termosensible. (B) Imagen SEM que muestra theragrippers junto a la punta de una aguja hipodérmica de calibre 22. Los theragrippers son lo suficientemente pequeños como para pasar de forma segura a través del tracto gastrointestinal sin causar ninguna obstrucción gástrica. (C) Imagen SEM que muestra un solo 250 μm, como el theragripper fabricado con el parche de quitosano encapsulado en el fármaco en el centro y la capa de activación de cera de parafina en las bisagras. (D) Imagen SEM de alta resolución que muestra la morfología de la superficie del parche de quitosano en el centro del theragripper. The patch has pores less than 100 nm in size. (E) Release characteristics of ketorolac (KT) from theragrippers of four different sizes. (F) Plot showing the relative scaling of the drug loading capacity of theragrippers of different sizes. The entire loaded drug gets released over a period of 24 hours. While the 250-μm theragrippers were used for our in vivo experiments in rats, larger 1.5-mm theragrippers can be loaded with about 100 times more drug, for use in larger animal models and humans. Crédito:Science Advances, doi:10.1126/sciadv.abb4133
Ex vivo and in vivo attachment followed by systemic drug delivery
The team performed ex vivo (experiments on tissue conducted externally in a laboratory) theragripper attachment studies using rat colon tissue and visualized surface penetration using scanning electron microscopy (SEM). During in vivo experiments in rats, Ghosh y col. deployed thousands of grippers in a single shot by using a pneumatic microfluidic controller (PMC). The team delivered the drug deploying theragrippers intrarectally via a pneumatic delivery system to jugular vein cannulated rats. The rat colon appeared normal at the sites of attachment, indicating the absence of tissue damage or inflammation. The team also conducted similar experiments with a porcine (pig) model to understand theragrippers as a resident device in the upper GI tract. During these investigations, the device transited through the esophagus in less than a minute and remained attached to the colon for up to a day. All experiments demonstrated the safe elimination of the grippers from the body through natural mucosal turnover. Each theragripper contained approximately 23 nanograms of ketorolac for sustained drug concentrations and showed delayed clearance compared with pristine ketorolac.
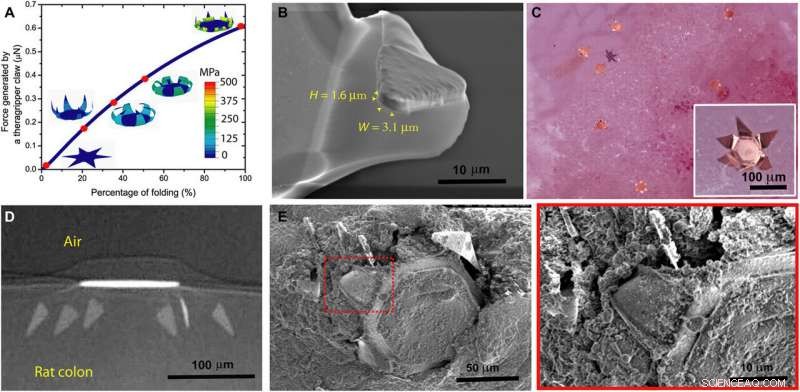
Theragrippers can apply sufficient force to penetrate the mucosa. (A) Plot of the force generated by a theragripper as a function of the percentage of folding, generated by FEM. Each claw of the theragripper can generate a maximum force of around 0.6 μN per hinge. Insets show the simulated configurations at different stages of the folding process marked by red dots. The colors in the legend indicate the magnitude of the von Mises stress in the gripper. (B) Close-up SEM image of the tip of a theragripper, showing the cross section of the tip having a width (W) of approximately 3.1 μm and a height (H) of 1.6 μm. To estimate the pressure exerted by this tip as the gripper actuates, we used the Hertz contact mechanics model and assumed the tip to be a sphere of diameter 1.6 to 3.1 μm. (C) Ex vivo experiment showing many theragrippers latching onto the colon of a rat. The inset shows the bright-field zoomed-in image of a single theragripper. (D) μ-CT image of the cross section of a theragripper penetrating into the colon ex vivo. (E) SEM image of a theragripper latching onto the colon mucosa ex vivo. (F) Zoomed-in image of the red outlined region in (E), showing the penetration of the claw into the colon tissue. Crédito:Science Advances, doi:10.1126/sciadv.abb4133
De este modo, Arijit Ghosh and colleagues developed a versatile platform of thermoresponsive theragrippers for drug dispersion in smaller conduits within the body. The team markedly improved the performance by altering the geometry, hydrogel matrix and drug formulation to observe drug release and the retention of grippers in the colon for 24 hours. Due to the thermoresponsive nature of theragrippers, the team will need to refrigerate the devices for immediate and long-term storage. They conducted proof-of-concept studies with the model drug ketorolac, which showed an increased half-life of almost 12 hours, the concept can be extended to other drugs. The new and versatile theragripper drug delivery system is based on self-latching in live animals and presents a new paradigm in drug administration.
© 2020 Science X Network