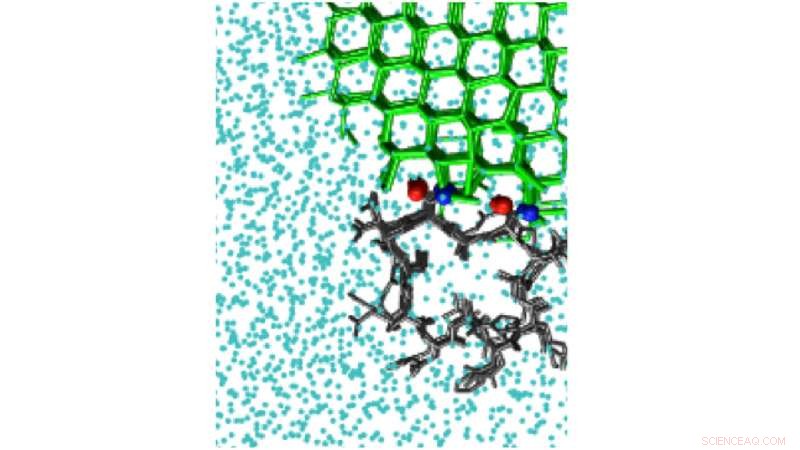
Las simulaciones de polarización del hielo pueden detectar el sitio de unión al hielo de la proteína anticongelante hiperactiva del escarabajo Tenebrio molitor, TmAFP. Crédito:Pavithra M. Naullage
Ciertas moléculas se unen fuertemente a la superficie del hielo, creando una interfaz curva que puede detener un mayor crecimiento de hielo. Algunos insectos plantas y las criaturas marinas contienen moléculas de proteínas de este tipo que actúan como agentes anticongelantes naturales, permitiendo que los organismos soporten temperaturas bajo cero.
En La Revista de Física Química , Los científicos informan sobre un método computacional para modelar la unión del hielo utilizando una técnica de sesgo para impulsar la formación de hielo en la simulación.
Las proteínas anticongelantes actúan uniéndose a una interfaz existente entre el hielo y el agua líquida. La superficie curva resultante detiene el crecimiento del hielo. También hay moléculas nucleantes de hielo que catalizan la formación de hielo a partir de agua líquida superenfriada.
Ambos fenómenos requieren una comprensión de la forma en que las moléculas se unen al hielo. Comprender la unión del hielo es importante para aplicaciones tan diversas como la criopreservación de órganos y el modelado climático, pero hasta la fecha no ha existido ningún método computacional para modelar eficientemente este fenómeno.
"La principal ventaja del enfoque de simulación de polarización del hielo es que identifica simultáneamente la superficie de unión al hielo, la cara de hielo a la que se une, y el modo de encuadernación, "dijo la autora Valeria Molinero.
Los investigadores crearon dos tipos de modelos. Un tipo es un modelo de todos los átomos que contiene todos los átomos en las fases líquida y helada del agua, así como en la molécula de tipo anticongelante. El otro tipo de modelo estudiado se llama modelo de grano grueso, lo que ahorra recursos computacionales al mezclar átomos en estructuras más simples.
El estudio analizó una serie de moléculas que se unen al hielo, incluido el alcohol polivinílico, un inhibidor sintético de la recristalización del hielo, así como proteínas anticongelantes naturales, como uno del escarabajo Tenebrio molitor. Las proteínas presentan un desafío de simulación, ya que tienen superficies muy pequeñas que se unen al hielo. Esto limita el tamaño de los cristales de hielo que pueden unir.
Algunos sistemas poseen más de una ubicación donde el hielo puede unirse. Este es el caso de la proteína anticongelante natural en la diatomea del hielo marino Frailariopsis cylindrus. Para determinar si una proteína como esta tiene más de una superficie de unión al hielo, SII, los investigadores desarrollaron un método que denominaron "limitar y repetir".
"En esta estrategia, Primero realizamos una simulación sesgada para detectar un SII. Luego, tapamos ese IBS para evitar la formación de hielo y realizamos una segunda simulación de sesgo para averiguar si se forma hielo en otros sitios, "dijo Molinero.
Los métodos desarrollados en este estudio son muy prometedores para una serie de aplicaciones, incluida la búsqueda de moléculas para proteger los tejidos congelados durante el almacenamiento, fomentar el conocimiento de las proteínas anticongelantes naturales, y en modelos climáticos, donde la nucleación del hielo en la atmósfera juega un papel clave.