
Imágenes de cristales de F420H2-oxidasa obtenidos aeróbicamente con un tamaño típico de 0,1 mm. Con oxígeno, el Fe y la flavina dentro de la enzima dan el color amarillo natural a los cristales. Crédito:Instituto Max Planck de Microbiología Marina / T. Wagner
El metano es un poderoso gas de efecto invernadero que juega un papel central en el ciclo global del carbono. Al mismo tiempo, es una fuente de energía importante para los seres humanos. Aproximadamente la mitad de su producción anual está hecha por microorganismos conocidos como metanógenos que descomponen material orgánico como plantas muertas. Esto normalmente ocurre en un hábitat sin oxígeno ya que este gas es letal para los metanógenos. Pero incluso en hábitats realmente libres de oxígeno, ocasionalmente aparecen moléculas de oxígeno. Para hacer inofensivos a estos intrusos, Los metanógenos poseen una enzima especial que puede convertir el oxígeno en agua.
"Las enzimas son componentes vitales del metabolismo de todos los organismos vivos y el objetivo de nuestro laboratorio es comprender cómo funcionan estas nanomáquinas a nivel molecular, "dice Tristan Wagner del Instituto Max Planck de Microbiología Marina y primer autor del estudio, publicado en la revista científica Comunicación química en septiembre de 2020. Para el estudio, Wagner cultivó un microorganismo anaeróbico llamado Methanothermococcus thermolithotrophicus, que se originó a partir del sedimento del Golfo de Nápoles. Purificó la enzima F420-oxidasa, una proteína flavodiiron, y lo cristalizó, un método común para estudiar el funcionamiento de las enzimas.
"Ya se sabía que la F420-oxidasa puede convertir el oxígeno en agua, ", dice Wagner." Pero logramos descifrar el mecanismo ". El estudio es una cooperación de científicos del Instituto Max Planck de Microbiología Marina, el Instituto Max Planck de Microbiología Terrestre, el Instituto Paul Scherrer, el Instituto de Investigación Interdisciplinar de Grenoble y el Centro Europeo de Radiación Sincrotrón.
El oxígeno está bloqueado
El mecanismo, los investigadores revelaron, tiene un requisito importante:el oxígeno es muy reactivo, por lo que es crucial que la reacción esté controlada correctamente por la enzima y que no haya disolventes flotando alrededor. De lo contrario, el oxígeno podría transformarse accidentalmente en superóxido y matar al anaerobio. El truco de la enzima F420-oxidasa es utilizar un canal de gas y un sistema de compuerta. La molécula de oxígeno se canaliza primero en el canal específico a una cavidad catalítica anhidra apropiada que contiene hierro. Luego, el hierro transforma el oxígeno en agua que será liberada por un mecanismo de compuerta. Para eso la cavidad comienza a moverse y abre una pequeña "puerta". Gracias al movimiento, el agua recién generada se transporta al exterior. La cavidad vacía se cierra de nuevo y está disponible para la siguiente molécula de oxígeno.
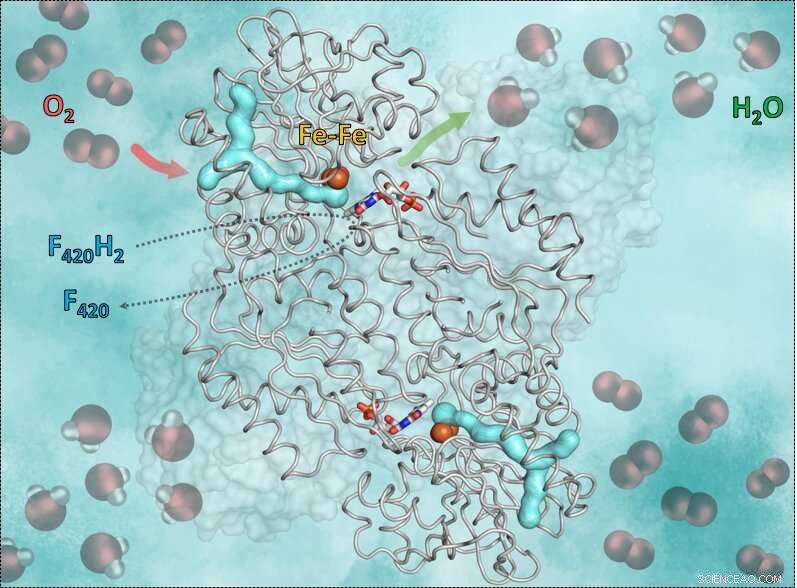
Este gráfico muestra la enzima F420H2-Oxidasa y su funcionamiento. La parte cian formada en Y es el canal de gas. La flecha roja muestra la entrada del oxígeno a la cavidad catalítica que contiene hierro. La flecha verde simboliza la salida del agua. Todavía, los palos azul-rojo en el medio muestran la flavina (FMN) aceptando electrones de la coenzima reducida F420, que aporta el hidrógeno necesario para convertir el oxígeno en agua. Crédito:S. Engilberge y T. Wagner
Para obtener información sobre este mecanismo, los científicos utilizaron cristalografía de rayos X. Primero obtuvieron la estructura cristalina sin oxígeno, donde pudieron ver la cavidad catalítica anhidra aislada del solvente. Luego, gasearon los cristales de enzima con el kriptón de gas inerte, cuales, a diferencia del oxígeno, puede hacerse visible mediante rayos X. Posteriormente, irradiaron los cristales de enzima y pudieron detectar átomos de criptón que mostraban el canal de gas que conduce a la cavidad catalítica. La proteína flavodiiron y su canal se conserva no solo en metanógenos, pero también en otros microorganismos como clostridios (que viven principalmente en el suelo o en el tracto digestivo), en la bacteria del azufre Desulfovibrio gigas o incluso en el parásito intestinal Giardia intestinalis.
Cuanto más rápido, mejor
"Esta reacción es muy rápida, ", dice Sylvain Engilberge del Instituto Paul Scherrer y primer autor del estudio junto a Tristan Wagner." Esta velocidad es también la gran importancia de nuestra investigación. "Enzimas similares como la lacasa son mucho más lentas". Para la aplicación futura de electroquímicos bioinspirados procesos, necesitamos aprender más de la reacción química, estructura y función de diferentes grupos de enzimas reductoras de oxígeno, ", dice Engilberge. También allanaría el camino de la ingeniería de proteínas para convertir un desintoxicante de O2 de alta tasa en un sumidero de electrones para procesos industriales.
"Nuestro próximo paso sería comprender la diversidad de la proteína flavodiiron, "dice Tristan Wagner. Algunos homólogos no apuntan al oxígeno sino al venenoso óxido nítrico, sus enzimas pueden discriminar entre ambos gases con alta especificidad. Pero, ¿qué es el filtro selectivo? ¿El canal de gas? ¿El entorno de la cavidad catalítica? "Deben realizarse más estudios para comprender cómo la proteína discrimina el oxígeno y el óxido nítrico, "agrega Wagner. Con tal conocimiento, Por ejemplo, sería posible predecir a partir de información genómica si una proteína de flavodiiron sería un eliminador de oxígeno o de óxido nítrico.