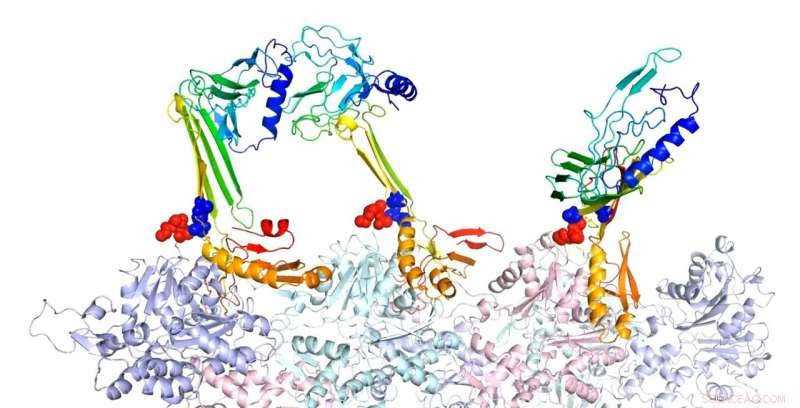
Investigadores de la Universidad de Rice modelaron las estructuras de unión de la actina y las proteínas asociadas que creen son responsables de la formación de la memoria a largo plazo. Aquí, La secuencia de cremallera en forma de horquilla beta es un núcleo potencial para la formación de láminas beta intramoleculares. En la estructura compleja predicha de F-actina y tres construcciones PRD + ABD mostradas arriba, las tres construcciones PDB + ABD se muestran en colores del arco iris, de azul a rojo, del terminal N al terminal C. Las superficies de los primeros 4 residuos negativos de los monómeros de actina están coloreadas en rojo y las superficies de los dos extremos positivos de la secuencia de la cremallera están coloreadas en azul. Crédito:Centro de Física Biológica Teórica / Universidad de Rice
Una proteína camaleónica en las neuronas puede cambiar de opinión, y en el proceso cambiamos nuestros cerebros.
Científicos de la Universidad Rice y del Centro de Ciencias de la Salud de la Universidad de Texas en Houston (UTHealth) descubrieron nuevas pistas en la proteína CPEB3 como parte de su persecución del mecanismo que permite a los humanos tener recuerdos a largo plazo.
El estudio del biofísico teórico de Rice Peter Wolynes y Neal Waxham, un neurobiólogo en la Escuela de Medicina McGovern de UTHealth, proporciona información sobre un ciclo de retroalimentación positiva entre la formación de las espinas dorsales de actina que dan a las espinas dendríticas su forma y flexibilidad y los dominios de unión a actina en CPEB3, un prión funcional que se une al ARN, que también forma agregados de larga duración que pueden, de hecho, almacenar la materia de la que están hechos los recuerdos.
Los modelos de plegamiento de proteínas de Wolynes y su grupo en el Centro de Rice para la Física Biológica Teórica (CTBP) y los experimentos en UTHealth revelaron detalles estructurales previamente desconocidos para CPEB3 y cómo se une a la actina. como se informa en el procedimientos de la Academia Nacional de Ciencias papel.
En el proceso, También examinaron el papel clave que desempeña una proteína conocida como SUMO, un regulador que se adhiere y se desprende de otras proteínas en las células para modificar sus funciones. Los investigadores sospechan que ayuda a regular cuándo y cómo los extremos camaleónicos de CPEB3 (el terminal N y el terminal C) se unen a SUMO o al flexible, espinas filamentosas de actina (f-actina) en picos dendríticos.
Las proteínas CPEB3 son solubles cuando se unen a SUMO, que también entierra sus sitios de unión a actina. Pero durante la actividad sináptica, pueden ser "desSUMOylated" y estar disponibles para unirse con las bolsas de unión hidrófobas a lo largo de los filamentos de f-actina.
Los modelos muestran que cuando se sienten atraídos por la actina, CPEB3 pasa de una espiral enrollada de hélices a una estructura de hoja beta que se "cierra" en una configuración de horquilla que le permite agregarse con otras proteínas CPEB3.
Tras la agregación, CPEB3 parece traducir sus ARN mensajeros objetivo, que incluyen ARNm de actina que fortalece las uniones sinápticas esenciales para la memoria, completando el bucle positivo.
"Este es un proyecto más ambicioso que el estudio de actina-CaM quinasa, donde también simulamos un sistema de actina realmente enorme con una proteína realmente enorme, "Dijo Wolynes. En ese estudio, publicado hace un año, Los investigadores de CTBP modelaron cómo una proteína central (CaMKII) mantiene unidos los filamentos de actina paralelos, un estado que podría visualizarse en un microscopio electrónico por el laboratorio de Waxham.
Ahora los investigadores están definiendo los detalles estructurales que permiten que CPEB3 se una a actina o SUMO, pero no ambos. "Uno de los aspectos principales de este artículo es reconciliar esas dos partes bastante diferentes de la historia, ", dijo." Creemos que los terminales CPEB son camaleónicos porque permiten que la molécula elija si interactuará con el SUMO o con la actina.
"Aún no hemos llegado al final de la historia, ", Dijo Wolynes." Pero los últimos resultados nos colocan en un lugar razonable para decir más sobre el mecanismo ".