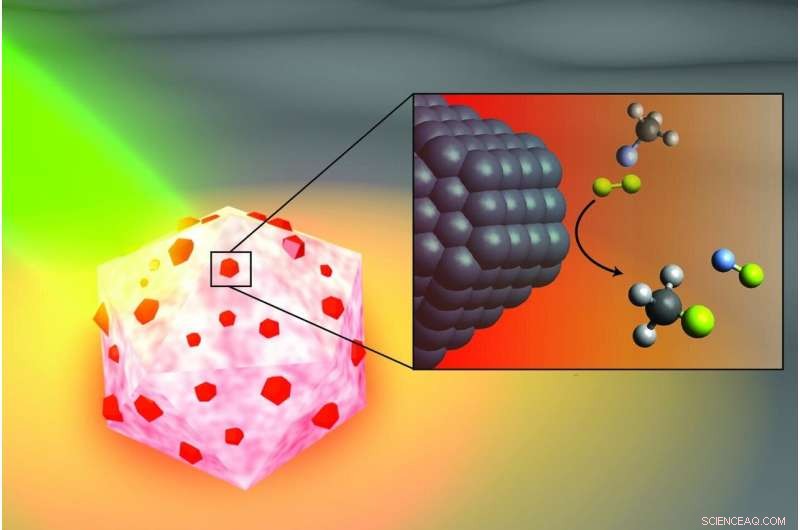
Ilustración de un artista del catalizador de antena-reactor activado por luz que los ingenieros de la Universidad de Rice diseñaron para romper los enlaces carbono-flúor en fluorocarbonos. La porción de aluminio de la partícula (blanca y rosa) captura energía de la luz (verde), islas de activación de catalizadores de paladio (rojo). En el recuadro, moléculas de fluorometano (arriba) compuestas por un átomo de carbono (negro), tres átomos de hidrógeno (gris) y un átomo de flúor (azul claro) reaccionan con moléculas de deuterio (amarillo) cerca de la superficie del paladio (negro), escindiendo el enlace carbono-flúor para producir fluoruro de deuterio (derecha) y metano monodeuterado (abajo). Crédito:H. Robatjazi / Rice University
Los ingenieros de la Universidad de Rice han creado un catalizador alimentado por luz que puede romper los fuertes enlaces químicos en los fluorocarbonos, un grupo de materiales sintéticos que incluye contaminantes ambientales persistentes.
En un estudio publicado este mes en Catálisis de la naturaleza , La pionera en nanofotónica de arroz, Naomi Halas, y colaboradores de la Universidad de California, Santa Bárbara (UCSB) y la Universidad de Princeton demostraron que pequeñas esferas de aluminio salpicadas de motas de paladio podrían romper los enlaces carbono-flúor (C-F) mediante un proceso catalítico conocido como hidrodesfluoración en el que un átomo de flúor es reemplazado por un átomo de hidrógeno.
La fuerza y la estabilidad de los enlaces C-F están detrás de algunas de las marcas químicas más reconocidas del siglo XX, incluido el teflón, Freon y Scotchgard. Pero la fuerza de esos enlaces puede ser problemática cuando los fluorocarbonos llegan al aire, suelo y agua. Clorofluorocarbonos, o CFC, por ejemplo, fueron prohibidos por un tratado internacional en la década de 1980 después de que se descubrió que estaban destruyendo la capa protectora de ozono de la Tierra, y otros fluorocarbonos figuraban en la lista de "sustancias químicas permanentes" a las que se refería un tratado de 2001.
"La parte más difícil de remediar cualquiera de los compuestos que contienen flúor es romper el enlace C-F; requiere mucha energía, "dijo Halas, ingeniero y químico cuyo Laboratorio de Nanofotónica (LANP) se especializa en crear y estudiar nanopartículas que interactúan con la luz.
En los últimos cinco años, Halas y sus colegas han sido pioneros en métodos para fabricar catalizadores de "reactor de antena" que estimulan o aceleran las reacciones químicas. Si bien los catalizadores se utilizan ampliamente en la industria, se utilizan normalmente en procesos que consumen mucha energía y requieren altas temperaturas, alta presión o ambas. Por ejemplo, se inserta una malla de material catalítico en un recipiente de alta presión en una planta química, y se quema gas natural u otro combustible fósil para calentar el gas o líquido que fluye a través de la malla. Los reactores de antena de LANP mejoran drásticamente la eficiencia energética al capturar energía luminosa e insertarla directamente en el punto de la reacción catalítica.
En el Catálisis de la naturaleza estudio, la antena de captura de energía es una partícula de aluminio más pequeña que una célula viva, y los reactores son islas de paladio esparcidas por la superficie del aluminio. La característica de ahorro de energía de los catalizadores de reactor de antena quizás se ilustra mejor con otro de los éxitos anteriores de Halas:el vapor solar. En 2012, su equipo mostró que sus partículas recolectoras de energía podrían vaporizar instantáneamente las moléculas de agua cerca de su superficie, lo que significa que Halas y sus colegas podrían producir vapor sin hervir agua. Para llevar a casa el punto, demostraron que podían producir vapor a partir de agua helada.
El diseño del catalizador de la antena-reactor permite al equipo de Halas mezclar y combinar los metales más adecuados para capturar la luz y catalizar reacciones en un contexto particular. El trabajo es parte del movimiento de la química verde hacia un limpiador, procesos químicos más eficientes, y LANP ha demostrado previamente catalizadores para producir etileno y gas de síntesis y para dividir amoniaco para producir combustible de hidrógeno.
El autor principal del estudio, Hossein Robatjazi, Beckman Postdoctoral Fellow en UCSB que obtuvo su Ph.D. de Rice en 2019, realizó la mayor parte de la investigación durante sus estudios de posgrado en el laboratorio de Halas. Dijo que el proyecto también muestra la importancia de la colaboración interdisciplinaria.
"Terminé los experimentos el año pasado, pero nuestros resultados experimentales tenían algunas características interesantes, cambios en la cinética de reacción bajo iluminación, eso planteó una pregunta importante pero interesante:¿Qué papel juega la luz para promover la química de ruptura de C-F? ", dijo.
Las respuestas llegaron después de que Robatjazi llegara para su experiencia postdoctoral en UCSB. Se le encomendó desarrollar un modelo de microcinética, y una combinación de conocimientos del modelo y de cálculos teóricos realizados por colaboradores de Princeton ayudó a explicar los desconcertantes resultados.
"Con este modelo, Usamos la perspectiva de la ciencia de la superficie en la catálisis tradicional para vincular de manera única los resultados experimentales con los cambios en la vía de reacción y la reactividad bajo la luz. " él dijo.
Los experimentos de demostración con fluorometano podrían ser solo el comienzo del catalizador de ruptura C-F.
"Esta reacción general puede ser útil para remediar muchos otros tipos de moléculas fluoradas, "Dijo Halas.