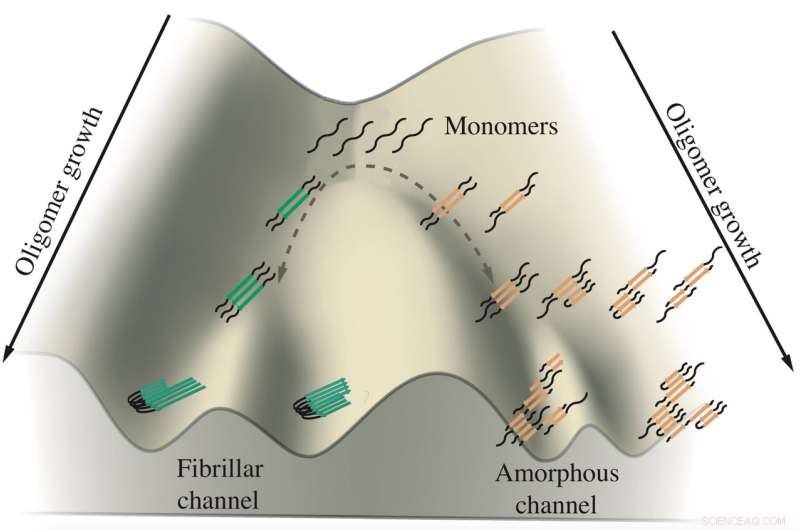
Un esquema muestra el crecimiento de oligómeros tau implicados en las enfermedades de Alzheimer y Pick. Los monómeros de tau tienden a agregarse a lo largo de dos canales, uno conduce a fibrillas que forman ovillos y el otro conduce a grupos amorfos en neuronas. Los investigadores de la Universidad de Rice simularon las proteínas en modelos computacionales para ver cómo y dónde ocurre la ramificación. Crédito:Centro de Física Biológica Teórica
Nuevas simulaciones realizadas por científicos de la Universidad de Rice cuentan la historia de dos taus y cómo se relacionan con las enfermedades neurológicas.
Su trabajo sugiere que las proteínas tau toman cualquiera de dos caminos para formar agregados sospechosos de promover, y tal vez causando, Enfermedades de Alzheimer y Pick (también conocidas como demencia frontotemporal). Precisamente por qué sigue siendo un misterio, pero averiguarlo ofrece la posibilidad de controlar su destino.
Proteínas tau, particularmente en neuronas, regular principalmente los microtúbulos, los filamentos que sirven como caminos para la carga dentro de una celda y facilitan la división. Pero vienen en muchas formas y, como resulta, estos pueden agregarse de distintas formas.
El estudio del biofísico Peter Wolynes y su equipo en el procedimientos de la Academia Nacional de Ciencias es el primer análisis computacional que establece una distinción entre las proteínas que forman las fibrillas sólidas que se encuentran en los cerebros de los pacientes con Alzheimer y Pick o desordenados, grupos parecidos a plantas rodadoras que flotan en el citoplasma de las neuronas.
"Existe una relación entre la forma que se convierte en orgánulos sin membrana (las plantas rodadoras) y la forma que se convierte en fibras, "dijo Wolynes, codirector del Centro de Rice de Física Biológica Teórica. "Parece haber dos caminos distintos que puede seguir la misma molécula de tau, y el equilibrio entre las dos vías se ve afectado por algún proceso biológico ".
Dijo que los modelos sugieren que la fosforilación, que regula muchos procesos de señalización celular, puede ser el factor determinante.
"Una vez que averigüemos cuál de estos agregados es el verdadero malo, entonces debería ser posible intervenir en, decir, el proceso de fosforilación en sí para cambiar el equilibrio, "Dijo Wolynes.
El laboratorio de Rice utilizó su AWSEM de grano grueso (memoria asociativa, mediada por agua, estructura y modelo energético) herramienta de análisis, que predice cómo se pliegan las proteínas, en una variedad de modelos de proteína tau basados en variantes de pacientes. Descubrieron que la formación de fibras puede manipularse mediante la fosforilación que se produce en una multitud de sitios de la proteína tau.
"Descubrimos que la fosforilación fomentaba la formación del agregado amorfo, pero no fomentó la formación de la fibra, en tanto, de todas formas, "Dijo Wolynes.
La fosforilación también puede salirse de los rieles, él dijo. "Hay algo así como 20 sitios a lo largo de la proteína tau que pueden fosforilarse, pero en general, solo cuatro o cinco de ellos son, "Dijo Wolynes." Pero a veces, se han hiperfosforilado, lo que significa que las enzimas responsables del proceso hacen más. Terminan con decir, 10 sitios fosforilados en lugar de cinco, y eso puede tener algún efecto.
"Si la fosforilación adicional puede causar más enfermedad, querríamos averiguar qué quinasas hacen la fosforilación e intentar inhibirlas con un fármaco, como lo hacemos en el tratamiento del cáncer, " él dijo.
Las proteínas Tau exhibieron otra característica interesante llamada retroceso, que los investigadores vieron en los péptidos beta amiloides que también están implicados en el Alzheimer. Ambos tienden a agregarse hasta que las barreras energéticas los obligan a desplegarse parcialmente y luego buscan otro camino hacia su final, formas más estables.
Es en ese punto de frustración que la agregación de taus parece ramificarse en diferentes direcciones, Dijo Wolynes. Un conjunto de tau forma fibrillas paralelas que se agregan en las placas ordenadas observadas en los cerebros de los pacientes, mientras que el otro se agrega libremente en el grupo flotante. Los investigadores sugirieron que el mecanismo de retroceso puede ser una característica universal en la agregación de proteínas, un tema de estudio futuro.
Los agregados sueltos presentan sus propios desafíos para los científicos, Dijo Wolynes.
"Son una cuestión de física en el siguiente sentido:son objetos localizados, pero ¿por qué no se juntan todos y forman un enorme orgánulo? como lo que pasa con las gotas de aceite en el agua? ”, dijo.“ ¿Es solo que les toma demasiado tiempo moverse? ¿Es que se fabrican y desmontan constantemente? ¿Y qué determina su tamaño?
"En este punto, sigue siendo una historia muy básica y bastante simple, "Dijo Wolynes." La historia real de tau todavía es demasiado complicada para nosotros, pero lo que hemos aprendido hasta ahora es bastante sencillo ".