En el nuevo diseño de ánodo de los investigadores, el galio se funde y solidifica repetidamente, "Curando" las grietas que de otro modo disminuirían gradualmente la capacidad de la batería para mantener una carga. Crédito:Universidad de Pensilvania
Las baterías recargables de iones de litio (Li-ion) son una tecnología revolucionaria, se encuentra en todo, desde teléfonos celulares hasta automóviles. Su ubicuidad y su papel en la ruptura de la dependencia de los combustibles fósiles le valieron a un trío de investigadores el Premio Nobel de Química de este año.
Pero incluso cuando la tecnología de las baterías de iones de litio está siendo reconocida con uno de los principales premios de la ciencia, la química detrás de ellos se enfrenta a un desafío inminente. Las baterías de iones de litio no se pueden recargar indefinidamente; los materiales en los electrodos de estas baterías se expanden y agrietan con cada ciclo, disminuyendo gradualmente su rendimiento de almacenamiento hasta que sean inútiles. La demanda resultante de litio fresco, el cobalto y otros elementos necesarios ejercen presión sobre los recursos naturales.
Con este desafío en mente, Los ingenieros de Penn están buscando diseñar electrodos de batería recargable que puedan funcionar de manera eficiente con iones metálicos distintos del litio. Las baterías de iones de magnesio son una alternativa prometedora, pero los materiales que pueden almacenar magnesio de manera reversible hasta ahora han sido incluso más susceptibles al agrietamiento y otros problemas que sus primos de iones de litio.
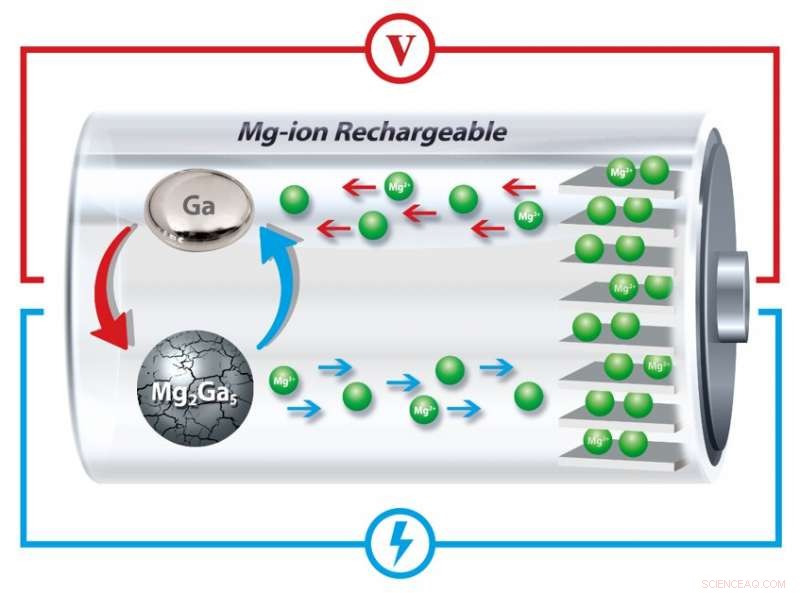
Los investigadores de Penn ahora han encontrado una solución incorporando galio, un metal que tiene un punto de fusión unos grados más alto que la temperatura ambiente, en el ánodo de una batería de iones de magnesio. Al fundirse y solidificarse con cada ciclo de carga y descarga, estos ánodos pueden "curar" el agrietamiento y la expansión subsiguiente que normalmente degradan el almacenamiento de la batería recargable.
Sus experimentos muestran que este nuevo ánodo prolonga significativamente la vida útil de las baterías de iones de magnesio, y lo hace sin la necesidad de costosos materiales a nanoescala. Estos rasgos podrían hacer que las baterías de iones de magnesio sean una buena opción para aplicaciones a gran escala, quitar presión a los recursos de litio.
Los investigadores demostraron su ánodo a base de galio en un estudio publicado en Materiales energéticos avanzados .
El estudio fue dirigido por Eric Detsi, Stephenson Term Assistant Professor en el Departamento de Ciencia e Ingeniería de Materiales, junto con Lin Wang y Samuel Welborn, estudiantes graduados en su laboratorio. Colaboraron con Vivek Shenoy, Profesor Distinguido del Presidente Eduardo D. Glandt en el Departamento de Ciencia e Ingeniería de Materiales.
"Para la mayoría de los vehículos eléctricos, el peso de la batería representa aproximadamente una quinta parte del peso total del vehículo. Depender únicamente de las baterías de iones de litio para alimentar estos vehículos en todo el mundo supondrá una presión considerable sobre los recursos de litio y cobalto utilizados en las baterías. ", Dice Detsi." Ya se están volviendo más caros debido a la demanda, y el mercado mundial de cobalto depende en gran medida de los suministros de países con altos riesgos geopolíticos ".
"Es obvio que se necesitan tecnologías de baterías alternativas, ", dice." No para reemplazar el litio, sino para soportar el litio ".
Cargar y descargar una batería implica reacciones químicas que permiten que los iones se muevan de un electrodo de la batería al otro. ganando o liberando electrones en el proceso. Sin embargo, Cualquiera que tenga un teléfono celular o una computadora portátil viejos sabe que estas baterías pierden su capacidad de mantener una carga con el tiempo. Una de las principales razones por las que estas baterías fallan es que el ciclo de carga y descarga implica una transformación física de los materiales en los electrodos. Cuando se incorporan iones al electrodo, esos materiales se expanden, y cuando los iones se liberan del electrodo, los materiales se agrietan. Este proceso continúa hasta que los materiales se rompen y pierden físicamente el contacto eléctrico con los electrodos. inutilizando la batería.
"El cambio de volumen que ocurre en la mayoría de los materiales de los electrodos debido a la incorporación y liberación de iones conduce al agrietamiento y la pulverización. Es una de las cosas que matan a una batería, "dice Wang." Esta pulverización está asociada con la acumulación de tensión que viene con una transformación de fase sólida-sólida ".
"En nuestro nuevo trabajo, sin embargo, "Welborn dice, "en lugar de una transformación de un tipo de sólido a otro, el material sólido original se transforma en líquido. Esto inhibe el agrietamiento y la pulverización porque las tensiones asociadas con la transformación normal sólido-sólido ya no están presentes ".
A temperatura ambiente, el galio puro es maleable, metal plateado que podría confundirse fácilmente con aluminio o níquel. Sosteniendo algo en tu mano sin embargo, revela rápidamente una propiedad única:con un punto de fusión de 85 grados Fahrenheit, La temperatura corporal es suficiente para convertir una pieza sólida de galio en un líquido similar al mercurio.
En el nuevo estudio de los investigadores, el galio comienza en forma sólida porque está aleado con magnesio en partículas del tamaño de una micra.
"Para conectar electrónicamente estas pequeñas piezas, "Wang dice, "los ponemos en una red conductora de fibras de carbono, negro de carbón y grafeno, todo unido con un aglutinante ".
Cuando los iones de magnesio se separan del galio, se transforma en su estado líquido porque la batería funciona a temperaturas ligeramente superiores al punto de fusión del galio.
"Dado que está incluido en esta red de otros materiales, "Welborn dice, "cuando el galio pasa de sólido a líquido, no se mueve como cabría esperar de un líquido ".
Usando rayos X para examinar la estructura cristalina de los materiales dentro de la batería, los investigadores demostraron que cuando la batería se carga, los iones regresan al ánodo y vuelven a formar partículas sólidas de galio-magnesio.
Críticamente, dado que estas partículas se reconstituyen con cada ciclo, no experimentan el tipo de agrietamiento que eventualmente degrada otras baterías.
La batería experimental de los investigadores resistió más de mil ciclos de carga, aproximadamente cinco veces más que la batería de iones de magnesio de última generación.
"Los mil ciclos demostrados en este trabajo representan una mejora significativa, "Detsi dice, "pero nuestro sueño es aprovechar este comportamiento de autocuración único para diseñar una batería que se pueda cargar y descargar para siempre".
El límite en la vida útil de mil ciclos de la nueva batería no se debe al electrodo, sino más bien el electrolito, el medio líquido que mueve los iones de un electrodo a otro. Investigaciones anteriores del grupo de Detsi han demostrado el papel que juega el electrolito en la degradación lenta de los electrodos de la batería. y el trabajo futuro se centrará en cómo mejorar ese proceso.
Afortunadamente, como con el diseño de los electrodos autorreparables del estudio, trabajar en este aspecto del diseño de baterías implica aplicaciones inteligentes de la química, en lugar de técnicas de nanotecnología con costos prohibitivos, implican otros intentos de prolongar la vida útil de la batería.
"Para solucionar los problemas con las baterías de iones de litio, la comunidad de baterías suele utilizar nanomateriales, "Dice Detsi". Sin embargo, la síntesis de nanomateriales puede ser compleja, lo que significa que fabricar toneladas de nanomateriales a escala industrial para aplicaciones de baterías puede resultar muy caro. Un aspecto notable de nuestro diseño es que no es necesario utilizar nanomateriales, lo que hace que esta clase de baterías sea muy atractiva para aplicaciones a gran escala ".