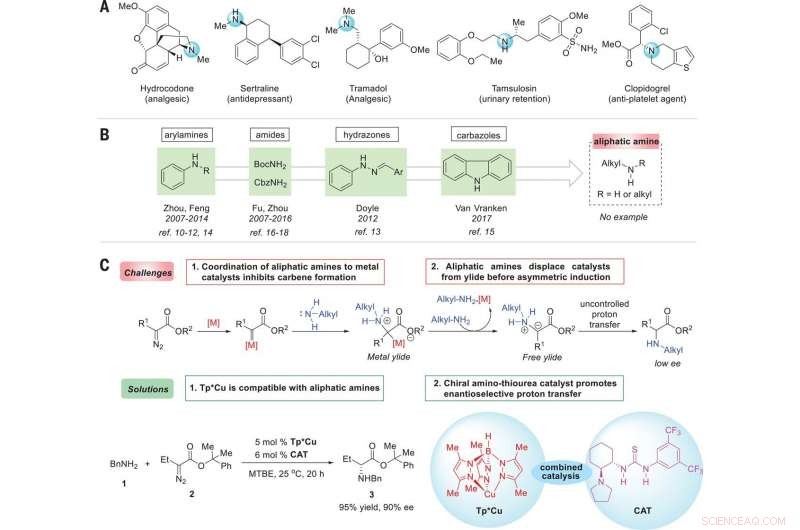
Estrategia para el enantiocontrol de reacciones de inserción de N – H de aminas alifáticas con carbenos. (A) Medicamentos representativos que demuestran la ubicuidad de las aminas alifáticas quirales en moléculas bioactivas. (B) Fuentes de amina informadas para reacciones de inserción de N – H enantioselectivas. (C) Reacciones de inserción de N – H catalizadas por metales de transición enantioselectivos con aminas alifáticas:desafíos y soluciones. Condiciones óptimas de reacción:la reacción de 1 (0,2 mmol), 2 (0,22 mmol), Tp * Cu (5% en moles), y se llevó a cabo CAT (6% en moles) en 3 ml de metil terc-butil éter (MTBE) a 25ºC durante 20 horas. BnNH2, bencilamina; BocNH2, carbamato de terc-butilo; CbzNH2, carbamato de bencilo; Me, metilo; Et, etilo; Ph, fenilo; METRO, metal; árbitro., referencia. Crédito: Ciencias (2019). doi:10.1126 / science.aaw9939
Un equipo de químicos de la Universidad de Nankai ha desarrollado un enfoque de dos pasos para convertir aminas alifáticas en aminoácidos no naturales. En su artículo publicado en la revista Ciencias , el grupo describe su enfoque, que tan bien funciono, y aplicaciones que podrían beneficiarse de su uso. John Ovian y Eric Jacobsen, de la Universidad de Harvard, han publicado un artículo complementario en el mismo número de la revista que describe algunos de los obstáculos para forjar enlaces con reactivos ricos en nitrógeno; también describe el enfoque utilizado por el equipo en China.
Los investigadores comenzaron señalando que las aminas quirales se utilizan en una amplia variedad de productos naturales, y señalar que también se utilizan con la misma frecuencia en agroquímicos y productos farmacéuticos. Señalan que el 43 por ciento de los 200 medicamentos recetados más recetados en 2016 tenían al menos una fracción de amina analifática. Además, señalan que debido a esto, el desarrollo de reacciones enantioselectivas catalizadas por metales de transición que forman enlaces C – N es de gran interés en los círculos de la química.
Como señalan Ovian y Jacobsen, Los químicos utilizan una variedad de compuestos que tienen enlaces carbono-nitrógeno en una de las dos posibles orientaciones de imagen especular. Pero como también señalan, hacerlo puede presentar dificultades debido a que el nitrógeno interactúa con un catalizador dado. En este nuevo esfuerzo, los investigadores han encontrado una forma de solucionar este problema desarrollando un enfoque de dos pasos para convertir aminas alifáticas en aminoácidos no naturales. En su enfoque, aplicaron un catalizador de cobre para que sirviera como medio para activar un reactivo de carbono y luego añadieron un catalizador de tiourea que formaba puentes de hidrógeno para producir productos de alta selectividad. Señalan que el éxito de la transformación dependió de las propiedades únicas de ambos catalizadores. Además, informan que la reacción resultante debería funcionar igualmente bien con una amplia gama de derivados diazo de un compañero de acoplamiento éster / amina.
Ovian y Jacobsen señalan además que el emparejamiento de una amina con un carbenoide permitió la estabilización por un grupo carboxilo y proporcionó una buena manera de crear derivados de α-aminoácidos no naturales. El método también traza un camino para extender las inserciones de carbenoides catalizadas por metales en enlaces N-H a aminas alifáticas y representa el potencial de desarrollar nuevas transformaciones asimétricas.
© 2019 Science X Network