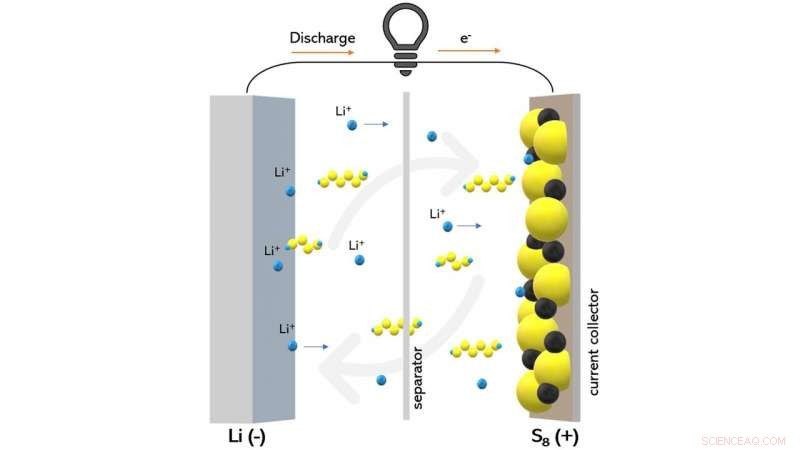
Este diagrama muestra una batería de litio-azufre durante la descarga. Los científicos pudieron observar cómo cierto tipo de material electrolítico puede reducir el transporte de compuestos de polisulfuro (que se muestran como cadenas amarillas y azules) que perjudican el rendimiento de la batería. Crédito:Wikipedia / Creative Commons
Las baterías de iones de litio representan la mayoría de las baterías de la electrónica de consumo y los vehículos eléctricos. Hoy dia, Los científicos están buscando nuevas sustancias químicas que puedan mejorar la densidad de energía y el rendimiento de las baterías más allá de las baterías de iones de litio convencionales.
Un tipo de estas baterías, llamadas baterías de litio-azufre, podría ofrecer más densidad de energía y menor costo que la batería tradicional de iones de litio de óxido de metal / grafito. Sin embargo, su rendimiento se ve afectado con frecuencia por una reacción parasitaria que ocurre dentro de la batería y que le impide funcionar con la misma eficiencia.
Ahora, en un nuevo estudio, Científicos del Laboratorio Nacional Argonne del Departamento de Energía de EE. UU. han descubierto cómo cierta clase de material electrolítico puede reducir la frecuencia de esta reacción. potencialmente allanando el camino para baterías de litio-azufre más efectivas.
Cuando se carga una batería de litio-azufre, Con frecuencia se produce una reacción secundaria inevitable llamada transporte de polisulfuro de litio. A medida que se carga la batería, el sulfuro de litio se convierte en azufre en el cátodo, pero algunos compuestos de litio-azufre que no están completamente oxidados pueden disolverse del cátodo en el electrolito, la región líquida de la batería que separa los dos electrodos.
En este punto, los compuestos de litio-azufre pueden difundirse y reducirse en el ánodo y volver a oxidarse en el cátodo. Este proceso puede repetirse una y otra vez de una manera que desperdicia la carga de la batería sin ponerla en funcionamiento.
"Con la lanzadera de polisulfuro, no obtiene nada de la batería excepto para calentarla, "dijo el químico de Argonne Chi Cheung Su, un autor del estudio. "En términos electroquímicos, es como intentar volar de Nueva York a Los Ángeles, pero atascado viajando de un lado a otro entre Chicago y Denver ".
Una gran parte del motivo del inicio del transporte de polisulfuros ocurre porque los polisulfuros pueden disolverse fácilmente en un electrolito que contiene una mezcla de disolventes de dos compuestos llamados dioxolano (DOL) y dimetoxietano (DME). "Hay dos problemas que debemos resolver simultáneamente:tener baja solubilidad y alta conductividad, "Su dijo". Al lograr ambos, podemos acercar estas baterías a la realidad ".
Según Su, Los últimos cinco años han visto el desarrollo de un nuevo tipo de material electrolítico que podría abordar ambos problemas. Este material, llamado hidrofluoroéter, o HFE, tiene una capacidad de solvatación mucho menor mientras mantiene una conductividad generalmente buena. "El primer paso para que el litio llegue al ánodo consiste en disolverlo en el electrolito, ", dijo." Como el agua es un buen solvente para la sal de mesa, DME es un muy buen solvente para litio. Pero con HFE es como tratar de disolver sal en gasolina ".
Aunque esta propiedad general de los HFE se conoce desde hace varios años, Su y sus colegas han ideado una forma general de predecir el comportamiento de solvatación y la conductividad de esta clase de moléculas. Primero, los dividieron en tres tipos dependiendo de sus estructuras químicas. Al medir el rendimiento de los electrolitos, los investigadores notaron una compensación importante:aquellas químicas que mostraban el comportamiento de solvatación más bajo y la menor cantidad de transporte de polisulfuro también tenían conductividades más bajas.
"Demuestra que todavía no existe una fórmula mágica para las baterías de litio y azufre, y que todavía tendremos que seguir buscando formas de mejorar las químicas que tenemos, "Su dijo.
Un artículo basado en la investigación, "Una regla de selección para el codisolvente electrolítico de hidrofluoroéter:establecimiento de una relación lineal de energía libre en baterías de litio-azufre, "apareció en la edición del 13 de mayo de Angewandte Chemie .