
El Dr. Ohkanda sostiene el compuesto estratégicamente diseñado para engancharse en el orificio de la enzima. Crédito:Junko Ohkanda Ph.D., Profesor de Asamblea Académica, Instituto de Agricultura, Universidad Shinshu
"La estrategia fue diseñar el fármaco para poder engancharse en el orificio de FTase y GGTase I, de lo contrario, la superficie de las proteínas es demasiado grande y resbaladiza, "La Dra. Junko Ohkanda de la Universidad Shinshu explica su estrategia detrás de su artículo elegido por Química:una revista europea como un "papel caliente".
Las compañías farmacéuticas de todo el mundo han estado tratando de inventar un fármaco eficaz para atacar las proteínas K-Ras durante los últimos 20 a 30 años. Cuando las proteínas K-Ras mutan, hacen que el interruptor de multiplicación permanezca encendido perpetuamente, convirtiéndose en una forma de cáncer agresiva e intratable. En 90 a 100% de los cánceres de pulmón y páncreas difíciles, Se dice que K-Ras juega un papel. Se dice que el 30% de todos los cánceres tienen alguna forma de mutación Ras.
Los científicos han tenido problemas para diseñar un fármaco para infiltrarse en K-Ras debido a la falta de bolsillos interactivos. Se ideó una nueva estrategia para atacar el FTase, una enzima importante en la modificación de lípidos de K-Ras. Sin FTase, el K-Ras mutado sería incapaz de multiplicarse incontrolablemente. Los científicos han desarrollado una gran cantidad de inhibidores de FTasa, pero le resultó difícil inactivar la modificación de K-Ras.
Incluso cuando la FTase estaba inhibida, Las modificaciones de K-Ras no se detuvieron porque GGTase I también estaba reaccionando con K-Ras, a pesar de su diferente cavidad reactiva. No se entendió por qué, hasta que se aclaró su mecanismo de que tanto FTasa como GGTasa I están formadas por dos partes proteicas, uno de los cuales es el mismo, con exactamente el mismo ADN.
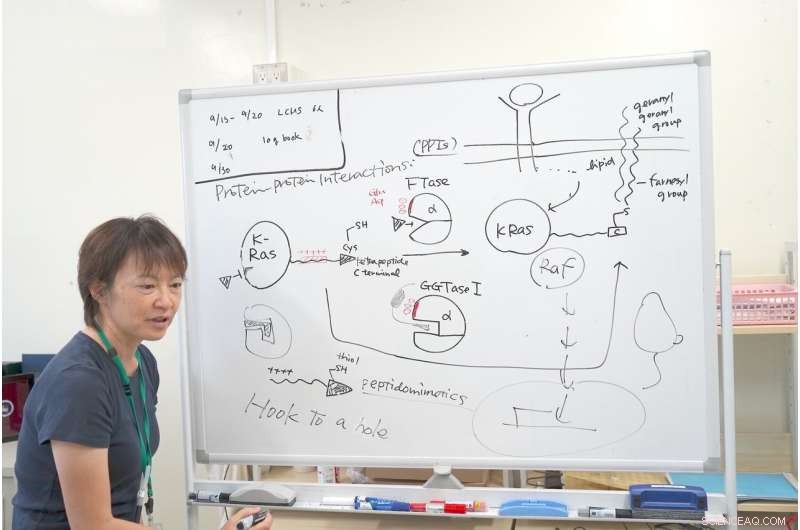
La Dra. Ohkanda explica el mecanismo de su investigación con K-Ras. Crédito:Junko Ohkanda Ph.D., Profesor de Asamblea Académica, Instituto de Agricultura, Universidad Shinshu
Cerca de la cavidad activada FTase y GGTase tengo el mismo grupo de aminoácidos ácidos, como el ácido glutámico y el ácido aspártico, llevando una carga negativa. Al observar de cerca el terminal C de K-Ras, tenía una carga positiva interactiva. Otras proteínas Ras no tienen esta área cargada positivamente. Solo K-Ras tiene este grupo de cargas positivas. Esta es la razón por la que incluso si se inhibió la FTasa, el K-Ras todavía reaccionó con el GGTase I, a pesar de que su cavidad era diferente.
Aquí es donde la Dra. Ohkanda tuvo su momento de inspiración. En teoria, el bolsillo de la enzima y la llave de cistina se unen y se unen. Pero en este caso las superficies de las proteínas, con el más y el menos también interactúan. Incluso si se inhibe la FTasa, K-Ras interactuó erróneamente con la GGTasa I. La Dra. Ohkanda y sus colegas pensaron que con un compuesto podrían realizar dos funciones.
La estrategia fue diseñar una molécula para imitar la parte del K-Ras que actúa sobre el bolsillo activo y también sobre la superficie ácida. No hace falta decir que la función del fármaco debe ocurrir dentro de la célula. Las moléculas grandes que son útiles en las interacciones proteína-proteína suelen ser demasiado grandes para entrar en la célula. Este es un problema que acecha a muchos desarrolladores de fármacos:los métodos de administración.
La Dra. Ohkanda pensó que si podía diseñar racionalmente el tiol en el extremo del K-Ras para engancharlo al bolsillo activo de FTase y GGTase I, la porción de carga positiva interactiva extendida podría interactuar y penetrar la membrana celular. Si la porción de cisteína pudiera engancharse en la cavidad, la cadena positiva interactiva conectada puede ser pequeña y entregarse estratégicamente a la superficie ácida de las enzimas. Era difícil minimizar el tamaño del compuesto mientras se aumentaba su estabilidad y se mantenía su capacidad para reacciones químicas. Al utilizar un peptidomimético de la misma longitud y clave, pudieron penetrar con éxito la célula in vitro, interrumpiendo la multiplicación descontrolada de K-Ras.
Se necesitan más estudios para aumentar la actividad del compuesto, probar in vivo y evaluar su toxicidad mucho antes de que el compuesto pueda usarse como tratamiento para cánceres. El Dr. Ohkanda continúa trabajando con un equipo internacional de expertos para dilucidar el mecanismo de acción y sus interacciones para diseñar racionalmente medicamentos efectivos para detener la multiplicación de tales células.